| โลหะ สามารถนำไฟฟ้าและความร้อนได้ดี มีลักษณะเป็นเงาและมีความวาวเมื่อถูกแสง นอกจากนี้ยังสามารถดึงเป็นเส้น ตีเป็นแผ่น หรือบิดงอได้โดยไม่แตกหัก ซึ่งคุณสมบัติที่สำคัญเหล่านี้ก็เนื่องจากโลหะยึดกันด้วยพันธะชนิดหนึ่ง นั่นก็คือ พันธะโลหะ ทฤษฎีที่ใช้อธิบายพันธะโลหะ 1. แบบจำลองทะเลอิเล็กตรอน ( electron sea model ) 2. ทฤษฎีแถบพลังงาน ( band theory ) 1. แบบจำลองทะเลอิเล็กตรอน ( electron sea model ) |

| จากรูปแสดงลักษณะของพันธะโลหะ ทรงกลมสีเทาคือ ไอออนบวกของโลหะ ทรงกลมสีแดงที่เคลื่อนที่อยู่ตลอดเวลานี้ คือ อิเล็กตรอน เรามักเรียกแบบจำลองของการเกิดพันธะโลหะนี้ว่า ทะเลอิเล็กตรอนเนื่องจากในผลึกของโลหะมีจำนวนอิเล็กตรอนมหาศาลที่ไหลไปมาได้อย่างอิสระตลอดเวลา โลหะมีค่าพลังงานไออไนเซซันที่ต่ำ ดังนั้นจึงยึดอิเล็กตรอนวงนอกสุดไว้อย่างหลวมๆ ทำให้อิเล็กตรอนเหล่านี้เคลื่อนที่ไปมารอบๆโลหะตลอดเวลาเหมือนกับว่าไม่ได้เป็นอิเล็กตรอนของอะตอมตัวใดตัวหนึ่ง แต่เป็นเสมือนกับว่าเป็นของอะตอมทุกตัว (มีล้านๆอะตอมในผลึกโลหะ) ซึ่งอิเล็กตรอนเหล่านี้ทำหน้าที่คล้ายซีเมนต์ ที่ช่วยยึดไอออนของโลหะที่มีประจุบวกให้อยู่ในตำแหน่งที่คงที่ การที่อิเล็กตรอนสามารถไหลไปมาในโลหะได้นี้ ทำให้โลหะมีคุณสมบัติเป็นตัวนำความร้อนและไฟฟ้าที่ดี (เมื่อมีสนามไฟฟ้ากระทำอิเล็กตรอนจะเคลื่อนที่เข้าหาขั้วบวก) และการที่อิเล็กตรอนทำหน้าที่คล้ายซีเมนต์นี้ (cement effect) ทำให้โลหะแข็ง ผิวหน้าของโลหะเป็นมันวาวเนื่องจากโลหะสามารถดูดกลืน และคายพลังงานได้ในช่วงความยาวคลื่นที่ต่อเนื่องกัน ทั้งนี้เนื่องจากอิเล็กตรอนอยู่ไม่ประจำที่และเคลื่อนที่ได้อย่างอิสระจึงสามารถมีพลังงานเท่าไหร่ก็ได้ 2. ทฤษฎีแถบพลังงาน (band theory) เมื่อออร์บิทัลอะตอมสองออร์บิทัลมารวมกันจะได้ออร์บิทัลโมเลกุลสองชนิดคือ ออร์บิทัลโมเลกุลแบบมีพันธะ (bonding molecular orbital) และออร์บิทัลโมเลกุลแบบต้านพันธะ (anti-bonding molecular orbital) ดังเช่นกรณีของ Li2 (Li : 1s22s1) ซึ่งแสดงออร์บิทัลโมเลกุลที่ระดับ 2s ได้ดังนี้ |
เมื่อมีอะตอมมากขึ้นและจำนวนออร์บิทัลโมเลกุลมากขึ้น ระดับพลังงานจะใกล้ชิดกันมากขึ้นจนดูเหมือนว่าเป็นแถบต่อเนื่องกัน แถบดังกล่าวนี้ เรียกว่า แถบพลังงาน (energy band) ดังรูป 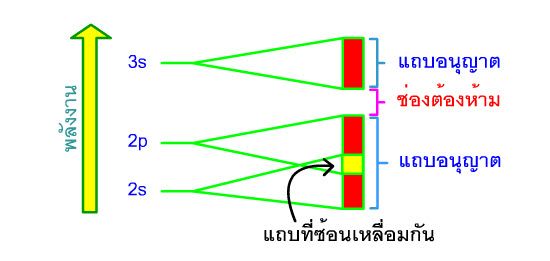 |
| อิเล็กตรอนจะมีพลังงานค่าต่างๆได้ภายในแถบ หรือภายในแถบที่มีการซ้อนเหลื่อมกันเท่านั้น (กรณีที่ระดับพลังงานไม่ห่างกันมากแถบพลังงานสามารถซ้อนเหลื่อมกันได้) แถบพลังงานนี้เรียกว่า แถบอนุญาต (allowed band) สำหรับช่วงที่ว่างที่ไม่มีแถบพลังงานเรียกว่า ช่องต้องห้าม (forbidden gap) 3.4.2 สมบัติของโลหะ
|


ไม่มีความคิดเห็น:
แสดงความคิดเห็น