
อิเล็กตรอนในอะตอมที่อยู่ ณ ระดับพลังงาน (energy levels หรือ
shell) จะมีพลังงานจำนวนหนึ่ง ส้าหรับอิเล็กตรอนที่อยู่ใกล้
นิวเคลียสมากที่สุดจะมีพลังงานน้อยกว่าพวกที่อยู่ไกลออกไป ยิ่งอยู่
ไกลมากยิ่งมีพลังงานมากขึ้น โดยกำหนดระดับพลังงานหลักให้เป็น
n ซึ่ง n เป็นจ้านวนเต็มคือ 1, 2, … หรือตัวอักษรเรียงกันดังนี้ จำนวน
อิเล็กตรอนที่จะมีได้ในแต่ละระดับพลังงานหลักต้องเท่ากับหรือไม่
เกิน 2n2 และจำนวนอิเล็กตรอนในระดับนอกสุดจะต้องไม่เกิน 8
2.3.2 ระดับพลังงานหลักและระดับพลังงานย่อย
____๘
จากการศึกษาสเปกตรัมของธาตุต่างๆ พบว่าในระดับพลังงาน
หลัก (n) ยังประกอบด้วยระดับพลังงานย่อยหรือเรียกว่า ซับเซลล์
(sub-levels หรือ sub-shells) โดยก้าหนดเป็นสัญลักษณ์คือ s p d
และ f ซึ่งในแต่ละระดับพลังงานย่อยจะมีอิเล็กตรอนได้ไม่เท่ากันและ
มีพลังงานไม่เท่ากัน กล่าวคือ ระดับพลังงานย่อย s มีพลังงานต่ำกว่า
p ต่ำกว่า d ต่ำกว่า f ตามล้าดับ ในระดับพลังงานย่อยยังประกอบด้วย
ออร์บิทัล (orbital) ซึ่งในแต่ละออร์บิทัลมีอิเล็กตรอนได้ไม่เกิน 2
อิเล็กตรอน ดังนี้
ระดับพลังงานย่อย s มีอิเล็กตรอนได้ไม่เกิน 2 อิเล็กตรอน มี 1
ออร์บิทัล
ระดับพลังงานย่อย p มีอิเล็กตรอนได้ไม่เกิน 6 อิเล็กตรอน มี 3
ออร์บิทัล
ระดับพลังงานย่อย d มีอิเล็กตรอนได้ไม่เกิน 10 อิเล็กตรอน มี
5 ออร์บิทัล
ระดับพลังงานย่อย f มีอิเล็กตรอนได้ไม่เกิน 14 อิเล็กตรอน มี 7
ออร์บิทัล
2.3.3 ออร์บิทัล

ระดับพลังงานที่หนึ่ง n = 1 (shell K) ปริมาณอิเล็กตรอนที่ควร
มีอยู่ = 2(1)2 = 2
ระดับพลังงานที่สอง (n = 2) ปริมาณอิเล็กตรอนสูงสุดที่ควรมี
ได้ = 2(2)2 = 8
ระดับพลังงานที่สาม (n = 3) ปริมาณอิเล็กตรอนสูงสุดที่ควรมี
ได้ = 2(3)2 = 18
ระดับพลังงานที่สี่ (n = 4) ปริมาณอิเล็กตรอนสูงสุดที่ควรมี
ได้ = 2(4)2 = 32
2.3.4 หลักการจัดเรียงอิเล็กตรอนในอะตอม
ในการบรรจุอิเล็กตรอนหรือการจัดเรียงอิเล็กตรอนลงในออร์บิทัล
จะต้องยึดหลักในการบรรจุอิเล็กตรอนของอะตอมหนึ่งๆ ลงในออร์บิ
ทัลที่เหมาะสมตามหลักดังต่อไปนี้
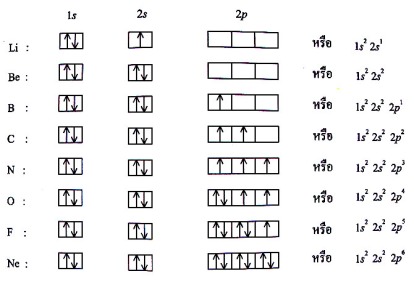
1) หลักของเพาลี (Pauli exclusion principle) กล่าวว่า
“ไม่มีอิเล็กตรอนคู่หนึ่งคู่ใดในอะตอมที่มีเลขควอนตัมทั้งสี่เหมือนกัน
ทุกประการ” นั่นคืออิเล็กตรอนคู่หนึ่งในออร์บิทัลจะมีค่า n, ℓ, mℓ
เหมือนกันได้ แต่ต่างกันที่สปิน
2) หลักของเอาฟ์บาว (Aufbau principle) มีวิธีการดังนี้
2.1) สัญลักษณ์วงกลม O, หรือ _ แทน ออร์บิทัล
ลูกศร ↑↓ แทน อิเล็กตรอน 1 ตัว ที่สปิน ขึ้น-ลง
↑↓ เรียกว่า อิเล็กตรอนคู่ (paired electron)
↑ เรียกว่าอิเล็กตรอนเดี่ยว (single electron)

2.2) บรรจุอิเล็กตรอนเข้าไปในออร์บิทัลที่มีระดับ
พลังงานต่ำจนครบจำนวนก่อน
3) กฎของฮุนด์ (Hund’s rule) กล่าวว่า “การบรรจุอิเล็กตรอน
ในออร์บิทัลที่มีระดับพลังงานเท่ากัน (degenerate orbital) จะบรรจุ
ในลักษณะที่ท้าให้มีอิเล็กตรอนเดี่ยวมากที่สุดเท่าที่จะมากได้” ออร์
บิทัลที่มีระดับพลังงานมากกว่า 1 เช่น ออรฺบิทัล p และ d เป็นต้น
ระดับพลังงานหลัก
|
จำนวนอิเล็กตรอนที่มีได้สูงสุด
|
ระดับพลังงานย่อยที่มีได้
|
n = 12
|
22
|
1s2
|
n = 22
|
82
|
2s2 2p6
|
n = 32
|
182
|
3s2 3p6 3d10
|
n = 42
|
322
|
4s2 4p6 4d10 4f14
|
n = 52
|
322
|
5s2 5p6 5d10 5f14
|
จากการเรียงอิเล็กตรอนของธาตุในระดับพลังงานหลักทำให้ทราบว่า
1. จำนวนระดับพลังงานหลักของอิเล็กตรอน ทำให้ทราบว่าธาตุนั้น
อยู่คาบใด ถ้าธาตุมีจำนวนระดับพลังงานของอิเล็กตรอนเท่ากัน
แสดงว่าธาตุนั้นอยู่ในคาบเดียวกัน เช่น
Mg มีเลขอะตอม 12 มีการจัดอิเล็กตรอนในระดับพลังงานดังนี้ 2, 8,
2 Mg มี 3 ระดับพลังงาน S มีเลขอะตอม 16 มีการจัดอิเล็กตรอนใน
ระดับพลังงานดังนี้ 2, 8, 6 S มี 3 ระดับพลังงาน
แสดงว่า Mg และ S อยู่ในคาบเดียวกัน
2.จำนวนเวเลนซ์อิเล็กตรอน หรืออิเล็กตรอนที่อยู่ในระดับพลังงานนอกสุด ทำให้ทราบหมู่ของธาตุ ถ้าธาตุมีจำนวนเวเลนซ์อิเล็กตรอนเท่ากัน แสดงว่าธาตุนั้นอยู่ในหมู่เดียวกัน เช่น
Na มีเลขอะตอม 11 มีการจัดอิเล็กตรอนในระดับพลังงานดังนี้ 2, 8, 1 Na มีเวเลนซ์อิเล็กตรอนเท่ากับ 1
K มีเลขอะตอม 19 มีการจัดอิเล็กตรอนในระดับพลังงานดังนี้ 2, 8,8, 1 K มี เวเลนซ์อิเล็กตรอนเท่ากับ
แสดงว่า ธาตุ Na และ K อยู่ในหมู่เดียวกัน
Na มีเลขอะตอม 11 มีการจัดอิเล็กตรอนในระดับพลังงานดังนี้ 2, 8, 1 Na มีเวเลนซ์อิเล็กตรอนเท่ากับ 1
K มีเลขอะตอม 19 มีการจัดอิเล็กตรอนในระดับพลังงานดังนี้ 2, 8,8, 1 K มี เวเลนซ์อิเล็กตรอนเท่ากับ
แสดงว่า ธาตุ Na และ K อยู่ในหมู่เดียวกัน
การจัดเรียงอิเล็กตรอนในระดับพลังงานย่อย
การจัดอิเล็กตรอนในระดับพลังงานหลัก ทำให้แต่ละระดับ
พลังงานมีจำนวนอิเล็กตรอนมากจึงเกิดปัญหาว่าอิเล็กตรอนเหล่านั้น
อยู่ในระดับพลังงานเดียวกันได้อย่างไร ทำไมจึงไม่ผลักกัน เพื่อแก้
ปัญหาดังกล่าว นักวิทยาศาสตร์จึงได้ศึกษาเกี่ยวกับระดับพลังงาน
ย่อยเพื่อกระจายอิเล็กตรอนในแต่ละระดับพลังงานหลัก เข้าสู่ระดับ
พลังงานย่อย โดยอาศัยรูปแบบโคจรของอิเล็กตรอนรอบ ๆ นิวเคลียส
เป็นเกณฑ์ในการแบ่งอิเล็กตรอนเป็นกลุ่มย่อย ๆ และเรียกรูปแบบวง
โคจรนี้ว่าออร์บิทัล (Orbital) โดย 1ออร์บิทัลจะมีอิเล็กตรอนได้ไม่
เกิน 2 อิเล็กตรอน ระดับพลังงานย่อยมี 4 ระดับ คือ s, p, d, f โดย
ระดับพลังงานย่อยมี
s มี 1 ออร์บิทัล บรรจุอิเล็กตรอนได้สูงสุด 2 อิเล็กตรอน
p มี 3 ออร์บิทัล บรรจุอิเล็กตรอนได้สูงสุด 6 อิเล็กตรอน
d มี 5 ออร์บิทัล บรรจุอิเล็กตรอนได้สูงสุด 10 อิเล็กตรอน
f มี 7 ออร์บิทัล บรรจุอิเล็กตรอนได้สูงสุด 14 อิเล็กตรอน
การจัดเรียงอิเล็กตรอนในระดับพลังงานย่อย
1.จัดอิเล็กตรอนในระดับพลังงานย่อยต่าง ๆ จะต้องจัดเข้าในระดับพลังงานย่อยที่มีพลังงานต่ำสุดก่อนแล้วจึงจัดเข้าสู่ระดับพลังงานย่อยที่มีพลังงานสูงขึ้น(ตามหลักของเอาฟบาว) ดังแผนผังต่อไปนี้
|
1s 2s 2p 3s 3p 4s 3d 4p 5s 4d 5p 6s 4f 5d 6p 7s
เช่น 17Cl มีการจัดเรียงอิเล็กตรอนในระดับพลังงานย่อย
1s2 2s2 2p6 3s2 3p5
21Se มีการจัดเรียงอิเล็กตรอนในระดับพลังงานย่อย
1s2 2s2 2p6 3s2 3p6 4s2 3d1
2. อิเล็กตรอน 2 ตัว ที่อยู่ในออร์บิทัลเดียวกัน จะต้องมีทิศทางการ
เคลื่อนที่สวนทางกันโดยแสดงทิศทางด้วยลูกศร ตามหลักการของเพาลี
3.การจัดอิเล็กตรอนเข้าสู่ระดับพลังงานย่อย ถ้าอิเล็กตรอนบรรจุ
อยู่กึ่งหนึ่งหรือบรรจุเต็มออร์บิทัลจะมีโครงสร้างแบบ
เสถียร เช่น 24Cr มีการจัดเรียงอิเล็กตรอนในระดับพลังงานย่อย
ดังนี้
1s2 2s2 2p6 3s2 3p6 4s1 3d5 ไม่ใช่ 1s2 2s2 2p6 3s2 3p6 4s2 3d4
เพราะโครงสร้างแบบแรกเสถียรกว่า เพราะ 4s และ 3d จะบรรจุกึ่ง
หนึ่ง
หรือเขียนโครงสร้างของอิเล็กตรอนแบบย่อ ๆ ได้ว่า (Ar) 4s1 3d5
|
ข้อสังเกตที่ได้จากการใช้จัดเรียงอิเล็กตรอนในอะตอม
1.เลขอะตอมคู่จะอยู่ในหมู่คู่ เลขอะตอมคี่จะเป็นธาตุในหมู่คี่ เช่น
ธาตุ 14Si จะเป็นธาตุในหมู่ 4
ธาตุ 11Na จะเป็นธาตุในหมู่ 1
2. ธาตุหมู่ IA และ IIA ตั้งแต่คาบ 3 ขึ้นไป จะมีจำนวนอิเล็กตรอน
ในระดับพลังงานถัดจากวงนอกสุดเข้ามา 1 ชั้นเป็น 8 เสมอ เช่น
11Na จะจัดเรียงอิเล็กตรอนเป็น 2, 8, 1 12Mg จะจัด
เรียงอิเล็กตรอนเป็น 2, 8, 2
19K จะจัดเรียงอิเล็กตรอนเป็น 2, 8, 8, 1 20Ca จะจัดเรียง
อิเล็กตรอนเป็น 2, 8, 8, 2
3.ธาตุหมู่ IIIA ถึง VIIIA ตั้งแต่หมู่ที่ IIIA คาบ 4 เป็นต้นไป จะมี
จำนวนอิเล็กตรอนในระดับพลังงานถัดจากวงนอกสุดเข้ามา 1 ชั้น
เป็น 18 เสมอ เช่น
31Ga 2, 8, 18, 3 (หมู่ 3 คาบ 4)
33As 2, 8, 18, 5 (หมู่ 5 คาบ 4)
4.ถ้าธาตุนั้นมีการจัดเรียงอิเล็กตรอนไม่เป็นไปตามข้อ 2 และ 3 คือมี
จำนวนอิเล็กตรอนในระดับพลังงานถัดจากวงนอกสุดเข้ามา 1 ชั้น มี
ค่าตั้งแต่ 9 – 18 แต่วงนอกสุดมีเวเลนซ์อิเล็กตรอน
เป็น 1หรือ 2 นักเรียนก็ทำนายได้ทันทีว่าเป็นธาตุแทรนซิชัน เช่น
29Cu 2, 8, 18, 1 ไม่ใช่เป็นธาตุหมู่ 1 แต่เป็นธาตุแทรนซิชันจัดเรียง
อิเล็กตรอนเป็น 2, 8,18, 1
23V 2, 8, 8, 5 ไม่ใช่เป็นธาตุหมู่ 1 แต่เป็นธาตุแทรนซิชันจัดเรียง
อิเล็กตรอนเป็น 2, 8,11, 2
หมายเหตุ ธาตุแทรนซิชันที่มีเลขอะตอมตั้งแต่ 21 – 30 จะมีเวเลนซ์อิเล็กตรอนเป็น 2 ยกเว้น Cuกับ Cr จะมีเวเลนซ์อิเล็กตรอนเป็น1

ไม่มีความคิดเห็น:
แสดงความคิดเห็น