เป็นพันธะที่เกิดจากการที่อะตอมหนึ่งเป็นฝ่ายให้อิเล็กตรอนระดับนอก และอีกอะตอมหนึ่งเป็นฝ่ายรับอิเล็กตรอนเข้ามาสู่ระดับนอก แล้วทำให้อะตอมทั้งสองฝ่ายอยู่ในสภาพเสถียร (ครบ 8 ตามกฎออกเตต) เช่น ธาตุในหมู่ 1A ซึ่งมีเวเลนซ์อิเล็กตรอนเท่ากับ 1 ถ้าเอาอิเล็กตรอนตัวนี้ออกไปเสีย อิเล็กตรอนในระดับถัดเข้าไปจะมีจำนวนเท่ากับ 8 ซึ่งเป็นโครงสร้างที่เสถียรเหมือนแก๊สเฉื่อย เช่น Na มีโครงสร้างอิเล็กตรอนเป็น 1s2 2s22p6 3s1 ถ้าเอาอิเล็กตรอน 3s1 ออกไป จะเกิดเป็น Na+ จะมีโครงสร้างอิเล็กตรอนเป็น 1s2 2s2 2p6 ซึ่งมีเวเลนซ์อิเล็กตรอนเท่ากับ 8 ซึ่งเป็นโครงสร้างที่เสถียรเหมือนแก๊สเฉื่อย คือ Ne ซึ่งมีโครงสร้างอิเล็กตรอนคือ 1s2 2s22p6 ส่วนธาตุในหมู่ 7A มีเวเลนซ์อิเล็กตรอนเท่ากับ 7 ต้องการอีก 1 ตัว จะครบ 8 เช่น Cl มีโครงสร้างอิเล็กตรอนเป็น 1s2 2s2 2p6 3s2 3p5 ถ้ารับอิเล็กตรอนเข้ามาหนึ่งตัวจะกลายเป็น Cl – โครงสร้างอิเล็กตรอนจะเปลี่ยนเป็น 1s2 2s2 2p6 3s2 3p6 ซึ่งเหมือนโครงสร้างอิเล็กตรอนของ Ar ซึ่งเป็นธาตุเฉื่อย

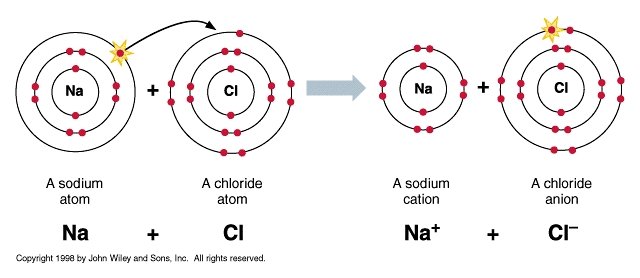
อะตอมที่มีอิเล็กตรอนระดับนอกจำนวนน้อย มีพลังงานการแตกตัวเป็นไอออนต่ำและมีสัมพรรคภาพอิเล็กตรอนต่ำ มีแนวโน้มที่จะเสียอิเล็กตรอนระดับนอกไปแล้วกลายเป็นไอออนบวก ส่วนธาตุที่มีอิเล็กตรอนระดับนอกมากมีพลังงานการแตกตัวเป็นไอออนสูง มีสัมพรรคภาพอิเล็กตรอนสูง มีแนวโน้มจะรับอิเล็กตรอนได้ง่ายและกลายเป็นไอออนลบ เมื่ออะตอมเหล่านี้ถ่ายโอนอิเล็กตรอนให้แก่กันแล้วเกิดเป็นไอออนบวกและไอออนลบ ซึ่งมีประจุไฟฟ้าต่างกันจึงเกิดแรงดึงดูดกันทางไฟฟ้ายึดเหนี่ยวให้ไอออนทั้งสองอยู่ด้วยกัน พันธะระหว่างไอออนบวกและไอออนลบนี้เรียกว่า พันธะไอออนิก หรือพันธะอิเล็กโทรเวเลนซ์ และเรียกสารประกอบที่เกิดขึ้นว่า สารประกอบไอออนิก
3.2.2 สูตรเคมีและชื่อของสารประกอบไออนิก
เนื่องจากสารประกอบไอออนิกมีลักษณะการสร้างพันธะต่อเนื่องกันเป็นผลึก ไม่ได้อยู่ในลักษณะของโมเลกุลเหมือนในสารประกอบโคเวเลนต์ ดังนั้นสารประกอบไอออนิกจึงไม่มีสูตรโมเลกุลที่แท้จริง แต่จะมีการเขียนสูตรเพื่อแสดงอัตราส่วนอย่างต่ำของจำนวนธาตุต่าง ๆ ที่เป็นองค์ประกอบ เช่น โซเดียมคลอไรด์ เกิดจากอะตอมของธาตุโซเดียม (Na) อย่างน้อยที่สุด 1 อะตอม และอะตอมของธาตุคลอรีน (Cl) อย่างน้อยที่สุด 1 อะตอม จึงสามารถเขียนสูตรได้เป็น NaCl โดยการเขียนสูตรของสารประกอบไอออนิกจะเขียนนำด้วยธาตุที่เกิดเป็นไอออนบวกก่อน จากนั้นจึงเขียนตามด้วยธาตุที่เกิดเป็นไอออนลบตามลำดับ
วิธีการอ่านชื่อสารประกอบไอออนิกให้อ่านตามลำดับของธาตุที่เขียนในสูตร คือ เริ่มจากธาตุแรกซึ่งเกิดเป็นไอออนบวก (ธาตุโลหะ) แล้วตามด้วยธาตุหลังซึ่งเป็นไอออนลบ (ธาตุอโลหะ) ดังนี้
1. เริ่มจากอ่านชื่อไอออนบวก (ธาตุโลหะ) ก่อน
2. อ่านชื่อธาตุไอออนลบ (ธาตุอโลหะ) โดยเปลี่ยนเสียงสุดท้ายเป็น -ไอด์ (-ide) ดังตัวอย่างเช่น
NaCl อ่านว่า โซเดียมคลอไรด์
MgO อ่านว่า แมกนีเซียมออกไซด์
Al2O3 อ่านว่า อะลูมิเนียมออกไซด์
3. หากไอออนลบมีลักษณะเป็นกลุ่มธาตุ จะมีชื่อเรียกเฉพาะที่แตกต่างกัน เช่น No3- เรียกว่า ไนเดรต, CO32-เรียกว่า คาร์บอเนต, SO42- เรียกว่า ซัลเฟต OH- เรียกว่า ไฮดรอกไซด์ เป็นต้น ดังตัวอย่างเช่น
CaCO3 อ่านว่า แคลเซียมคาร์บอเนต
Na2SO4 อ่านว่า โซเดียมซัลเฟต
วิธีการอ่านชื่อสารประกอบไอออนิกให้อ่านตามลำดับของธาตุที่เขียนในสูตร คือ เริ่มจากธาตุแรกซึ่งเกิดเป็นไอออนบวก (ธาตุโลหะ) แล้วตามด้วยธาตุหลังซึ่งเป็นไอออนลบ (ธาตุอโลหะ) ดังนี้
1. เริ่มจากอ่านชื่อไอออนบวก (ธาตุโลหะ) ก่อน
2. อ่านชื่อธาตุไอออนลบ (ธาตุอโลหะ) โดยเปลี่ยนเสียงสุดท้ายเป็น -ไอด์ (-ide) ดังตัวอย่างเช่น
NaCl อ่านว่า โซเดียมคลอไรด์
MgO อ่านว่า แมกนีเซียมออกไซด์
Al2O3 อ่านว่า อะลูมิเนียมออกไซด์
3. หากไอออนลบมีลักษณะเป็นกลุ่มธาตุ จะมีชื่อเรียกเฉพาะที่แตกต่างกัน เช่น No3- เรียกว่า ไนเดรต, CO32-เรียกว่า คาร์บอเนต, SO42- เรียกว่า ซัลเฟต OH- เรียกว่า ไฮดรอกไซด์ เป็นต้น ดังตัวอย่างเช่น
CaCO3 อ่านว่า แคลเซียมคาร์บอเนต
Na2SO4 อ่านว่า โซเดียมซัลเฟต
อัตราส่วนระหว่างไอออนบวกกับไอออนลบที่จะรวมตัวกันเป็นสารไอออนิกนั้น จะใช้อัตราส่วนที่ทำให้ประจุบวกกับประจุลบหักล้างกันหมดพอดี โดยเราสามรถใช้ค่าของประจุบวกไปเขียนไว้ทางด้านล่างขวาของอนุภาคที่เป็นไอออนลบ และใช้ค่าประจุลบไปเขียนไว้ทางด้านล่างขวาของอนุภาคที่เป็นไอออนบวก ดังรูป
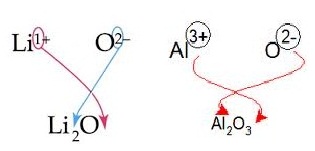
สารประกอบไอออนิกประกอบด้วยไอออนบวกและไอออนลบยึดเหนี่ยวกันด้วยแรงดึงดูดระหว่างประจุไฟฟ้าในการเขียนสูตรสารประกอบไอออนิกจึงต้องทราบว่าแต่ละธาตที่ทำปฏิกิริยากัน นั้นจะเกิดเป็นไอออนชนิดใด และมีจำนวนประจุเท่าใด ซึ่งพิจารณาได้จากการจัดเรียงอิเล็กตรอนของธาตุ ดังตัวอย่าง
3.2.3 พลังงานกับการเกิดสารประกอบไอออนิก
1.โลหะโซเดียมที่อยู่ในสถานะของแข็งระเหิดกลายเป็นไอ (กลายเป็นอะตอมในสถานะก๊าซ) ขั้นนี้ต้องใช้พลังงาน หรือดูดพลังงานเท่ากับ 109 kJ/mol เรียกพลังงานที่ใช้ในขั้นนี้ว่าพลังงานการระเหิด (Heat of siblimation) สัญลักษณ์ " Hs" หรือ "S"
Hs" หรือ "S"
Na(s)+ 109 kJ---------------->Na(g).........(1)
2.โมเลกุลของคลอรีน (Cl2(g)) ซึ่งอยู่ในสถานะก๊าซแตกตัวออกเป็นอะตอมในสถานะก๊าซ (Cl(g))
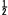 Cl
Cl
แต่ในการเกิด NaCl(s) 1 mol ต้องใช้ Cl(g) เพียง 1 mol ดังนั้น
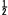 Cl2(g) +121 kJ-------------------->Cl(g).........(2)
Cl2(g) +121 kJ-------------------->Cl(g).........(2)
ขั้นนี้ต้องใช้พลังงานหรือดูดพลังงานเท่ากับ 121 kJ เรียกพลังงานที่ใช้ในขั้นนี้ว่า พลังงานสลายพันธะ หรือพลังงานการแตกตัว (Bond Dissociation energy) สัญลักษณ์ " Hdis" หรือ "d"
Hdis" หรือ "d"
3.อะตอมของโซเดียมในสถานะก๊าซ เสีย 1 เวเลนซ์อิเลคตรอน กลายเป็นโซเดียมไอออนในสถานะก๊าซ ขั้นนี้ต้องใช้พลังงานหรือดูดพลังงาน 494 kJ/mol เรียกพลังงานที่ใข้ในขั้นนี้ว่า พลังงานไอออไนเซชั่น(Ionization Energy) สัญลักษณ์ "IE" หรือ "I"
Na(g)+494 kJ----------------->Na (g) + e
(g) + e .........(3)
.........(3)
4.คลอรีนอะตอมในสถานะก๊าซรับอิเลคตรอนกลายเป็นคลอไรด์ไอออนในสถานะก๊าซ(Cl-(g)) ขั้นนี้คายพลังงานออกมา 347 kJ/mol พลังงานที่คายออกมาในขั้นนี้เรียกว่า อิเลคตรอนอัฟฟินิตีหรือสัมพรรคภาพอิเลคตรอน (Electron Affinity) สัญลักษณ์ E หรือ EA
Cl(g)+e- -----------------> Cl-(g)+347 kJ...........(4)
5.โซเดียมไอออนในสถานะก๊าซ และคลอไรด์ไอออนในสถานะก๊าซรวมตัวกันด้วยพันธะไอออนิกได้ผลึกโซเดียมครอไรด์ (NaCl(s)) ขั้นนี้คายพลังงานออกมา 787 kJ/mol พลังงานที่คายออกมาในขั้นนี้เรียกว่าพลังงานแลคทิซ หรือพลังงานโครงร่างผลึก (Lattic Energy) สัญลักษณ์ U หรือ Ec
Na+(g) + Cl-(g) ---------------------->NaCl(s)+787 kJ.........(5)
เมื่อเอาสมการ (1)+(2)+(3)+(4)+(5) จะได้สมการรวมหรือปฏิกิริยารวมดังนี้
Na(s)+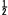 Cl
Cl (g)-----------------------> NaCl(s)+410 kJ..........(6)
(g)-----------------------> NaCl(s)+410 kJ..........(6)
แสดงว่าในการเกิด NaCl(s) เป็นการเปลี่ยนแปลงประเภทคายพลังงาน คือ เมื่อเกิด NaCl 1 mol จะคายพลังงานเท่ากับ 410 kJ
พลังงานที่คายออกมาเรียกว่า พลังงานของปฏิกิริยาหรือความร้อนของปฏิกิริยาหรือความร้อนของการเกิดสาร สัญลักษณ์ "

3.2.4 สมบัติของสารประกอบไอออนิก
1. มีขั้ว เพราะสารประกอบไอออนิกไม่ได้เกิดขึ้นเป็นโมเลกุลเดี่ยว แต่จะเป็นของแข็งซึ่งประกอบด้วยไอออนจำนวนมาก ซึ่งยึดเหนี่ยวกันด้วยแรงยึดเหนี่ยวทางไฟฟ้า
2. ไม่นำไฟฟ้าเมื่ออยู่ในสภาพของแข็ง แต่จะนำไฟฟ้าได้เมื่อใส่สารประกอบไอออนิกลงในน้ำ ไอออนจะแยกออกจากกัน ทำให้สารละลายนำไฟฟ้าในทำนองเดียวกันสารประกอบที่หลอมเหลวจะนำไฟฟ้าได้ด้วยเนื่องจากเมื่อหลอมเหลวไอออนจะเป็นอิสระจากกัน เกิดการไหลเวียนอิเล็กตรอนทำให้อิเล็กตรอนเคลื่อนที่จึงเกิดการนำไฟฟ้า
3 . มีจุหลอมเหลวและจุดเดือดสูง ความร้อนในการทำลายแรงดึงดูดระหว่างไอออนให้กลายเป็นของเหลวต้องใช้พลังงานสูง
ตารางแสดงจุดหลอมเหลว และจุดเดือดของสารประกอบไอออนิกบางชนิด
สารประกอบไอออนิก สูตรโมเลกุล จุดหลอมเหลว (๐C) จุดเดือด (๐C)
โซเดียมไฮดรอกไซด์ NaOH 318 1390
โพแทสเซียมไนเดรต KNO3 334 400
แคลเซียมคลอไรด์ CaCl2 772 มากกว่า 1600
โซเดียมคลอไรด์ NaCl 801 1465
อะลูมิเนียมออกไซด์ Al2O3 2054 2980
แมกนีเซียมออกไซด์ MgO 2800 3600
โซเดียมไฮดรอกไซด์ NaOH 318 1390
โพแทสเซียมไนเดรต KNO3 334 400
แคลเซียมคลอไรด์ CaCl2 772 มากกว่า 1600
โซเดียมคลอไรด์ NaCl 801 1465
อะลูมิเนียมออกไซด์ Al2O3 2054 2980
แมกนีเซียมออกไซด์ MgO 2800 3600
4 . สารประกอบไอออนิกทำให้เกิดปฏิกิริยาไอออนิก คือ ปฏิกิริยาระหว่างไอออนกับไอออน ทั้งนี้เพราะสารไอออนิกจะเป็นไอออนอิสระในสารละลาย ปฏิกิริยาจึงเกิดทันที
5 . สมบัติไม่แสดงทิศทางของพันธะไอออนิก สารประกอบไอออนิกเกิดจากไอออนที่มีประจุตรงกันข้ามรอบ ๆ ไอออนแต่ละไอออนจะมีสนามไฟฟ้าซึ่งไม่มีทิศทาง จึงทำให้เกิดสมบัติไม่แสดงทิศทางของพันธะไอออนิก
6. เป็นผลึกแข็ง แต่เปราะและแตกง่าย
5 . สมบัติไม่แสดงทิศทางของพันธะไอออนิก สารประกอบไอออนิกเกิดจากไอออนที่มีประจุตรงกันข้ามรอบ ๆ ไอออนแต่ละไอออนจะมีสนามไฟฟ้าซึ่งไม่มีทิศทาง จึงทำให้เกิดสมบัติไม่แสดงทิศทางของพันธะไอออนิก
6. เป็นผลึกแข็ง แต่เปราะและแตกง่าย
3.2.5 สมการไอออนิกและสมการไออนิกสุทธิ
เมื่อผสมสารละลายของสารประกอบไอออนิกบางชนิดเข้าด้วยกัน จะได้สารละลายที่มีไอออนของสารทั้งสองปนกันอยู่
ปรากฏเป็นสารละลายใส เช่น
ผสม NaCl (aq) กับ KNO3 (aq) เขียนสมการเคมีที่เกิดขึ้นได้ดังนี้
= NaCl (aq) + KNO3 (aq) ---------> NaNO3 (aq) + KCl (aq) หรือ
Na+ (aq) + Cl-(aq) + K+(aq) +NO3-(aq) ------------> Na+ (aq) + NO3-(aq) + K+(aq) + Cl-(aq)
เมื่อผสมกัน จะมีไอออนอยู่ในสารละลายทั้ง 4 ชนิด แสดงว่า ไม่เกิดผลิตภัณฑ์ที่เป็นของแข็ง จึงอยู่ใน
สภาพไอออน (มีน้ำล้อมรอบ) แต่เมื่อผสมสารละลายของสารประกอบไอออนิกบางชนิดเข้าด้วยกัน จะได้ผลิตภัณฑ์เป็นตะกอน
เกิดขึ้น เช่น
ผสม NaCl (aq) กับ AgNO3 (aq) เขียนสมการเคมีที่เกิดขึ้นได้ดังนี้
= NaCl (aq) + AgNO3 (aq) -----------------> NaNO3 (aq) + AgCl (s) หรือ
Na+ (aq) + Cl-(aq) + Ag+(aq) +NO3-(aq) ---------------> Na+ (aq) + NO3-(aq) + AgCl(s)
เมื่อผสมกันจะเกิดตะกอนของ AgCl(s) เขียนสมการแสดงการเกิดตะกอน AgCl ดังนี้
= Ag+(aq) + Cl-(aq) ---------------> AgCl(s) เรียกสมการนี้ว่า สมการไอออนิก
สมการไอออนิก (Ionic equation ) คือ สมการเคมีที่เขียนเฉพาะไอออนหรือโมเลกุลของสารที่มีส่วน
ในการเกิดปฏิกิริยา ส่วนไอออนหรือโมลกุลของสารใดไม่มีส่วนในการเกิดปฏิกิริยาไม่ต้องเขียน สมการไอออนิก จะต้องเป็น
สมการที่มีสารใดสารหนึ่งเป็นไอออนร่วมอยู่ด้วยในปฏิกิริยานั้น เช่น
Zn (s) + 2H+ (aq) ---------------> Zn2+ (aq) + H2 (g)
H+ (aq) + OH- (aq) --------------------> H2O (l)
หลักการเขียนสมการไอออนิก

https://sites.google.com/site/luckzynam/smbati-khxng-sarprakxb-xi-xx-nik-1
https://sites.google.com/site/chunyarat47158/phlangngan-kab-kar-keid-sarprakxb-xi-xx-nik

ไม่มีความคิดเห็น:
แสดงความคิดเห็น