2.1.1แบบจำลองอะตอมของดอลตัน

ในปี พ.ศ. 2346 (ค.ศ. 1803) จอห์น ดอลตัน (John Dalton) นักวิทยาศาสตร์ชาวอังกฤษได้เสนอทฤษฎีอะตอม เพื่อใช้อธิบายเกี่ยวกับการเปลี่ยนแปลงของสารก่อนและหลังทำปฏิกิริยา รวมทั้งอัตราส่วนโดยมวลของธาตุที่รวมกันเป็นสารประกอบ ซึ่งสรุปได้ดังนี้
1. ธาตุประกอบด้วยอนุภาคเล็กๆหลายอนุภาคเรียกอนุภาคเหล่านี้ว่า “อะตอม” ซึ่งแบ่งแยกและทำให้สูญหายไม่ได้
2. อะตอมของธาตุชนิดเดียวกันมีสมบัติเหมือนกัน แต่จะมีสมบัติ แตกต่างจากอะตอมของธาตุอื่น
3. สารประกอบเกิดจากอะตอมของธาตุมากกว่าหนึ่งชนิดทำปฏิกิริยา เคมีกันในอัตราส่วนที่เป็นเลขลงตัวน้อยๆ
จอห์น ดอลตัน ชาวอังกฤษ เสนอทฤษฎีอะตอมของดอลตัน
– อะตอมเป็นอนุภาคที่เล็กที่สุด แบ่งแยกอีกไม่ได้
– อะตอมของธาตุชนิดเดียวกันมีสมบัติเหมือนกัน
-อะตอมต้องเกิดจากสารประกอบเกิดจากอะตอม
ของธาตุตั้งแต่ 2 ชนิดขึ้นไปมารวมตัวกันทางเคมี
ทฤษฎีอะตอมของดอลตันใช้อธิบายลักษณะและสมบัติของอะตอมได้เพียงระดับหนึ่ง แต่ต่อมานักวิทยาศาสตร์ค้นพบข้อมูล บางประการที่ไม่สอดคล้องกับทฤษฎีอะตอมของ ดอลตัน เช่น พบว่าอะตอมของธาตุชนิดเดียวกันอาจมีมวลแตกต่างกันได้
ลักษณะแบบจำลองอะตอมของดอลตัน
 ทรงกลมตันมีขนาดเล็กที่สุดซึ้งแบ่งแยกอีกไม่ได้
ทรงกลมตันมีขนาดเล็กที่สุดซึ้งแบ่งแยกอีกไม่ได้
2.1.2. แบบจำลองอะตอมของทอมสัน
 เ เซอร์โจเซฟ จอห์น ทอมสัน นักวิทยาศาสตร์ชาวอังกฤษ ได้ทำการศึกษาและทดลองเกี่ยวกับการนำไฟฟ้าของก๊าซโดยใช้หลอดรังสีแคโทด
หลอดรังสีแคโทด
เป็นเครื่องที่ใช้ทดลองเกี่ยวกับการนำไฟฟ้าโดยหลอดรังสีแคโทดจะมีความดันต่ำมาก และความต่างศักย์สูงมาก วิลเลียม ครูกส์ได้สร้างหลอดรังสีแคโทดขึ้นมาโดยใช้แผ่นโลหะ 2 แผ่นเป็นขั้วไฟฟ้า โดยต่อขั้วไฟฟ้าลบกับขั้วลบของเครื่องกำเนิดไฟฟ้าเรียกว่า แคโทด และต่อขั้วไฟฟ้าบวกเข้ากับขั้วบวกของเครื่องกำเนิดไฟฟ้าเรียกว่า แอโนด
เ เซอร์โจเซฟ จอห์น ทอมสัน นักวิทยาศาสตร์ชาวอังกฤษ ได้ทำการศึกษาและทดลองเกี่ยวกับการนำไฟฟ้าของก๊าซโดยใช้หลอดรังสีแคโทด
หลอดรังสีแคโทด
เป็นเครื่องที่ใช้ทดลองเกี่ยวกับการนำไฟฟ้าโดยหลอดรังสีแคโทดจะมีความดันต่ำมาก และความต่างศักย์สูงมาก วิลเลียม ครูกส์ได้สร้างหลอดรังสีแคโทดขึ้นมาโดยใช้แผ่นโลหะ 2 แผ่นเป็นขั้วไฟฟ้า โดยต่อขั้วไฟฟ้าลบกับขั้วลบของเครื่องกำเนิดไฟฟ้าเรียกว่า แคโทด และต่อขั้วไฟฟ้าบวกเข้ากับขั้วบวกของเครื่องกำเนิดไฟฟ้าเรียกว่า แอโนด
 การค้นพบอิเล็กตรอน
เซอร์โจเซฟ จอห์น ทอมสัน ดัดแปลงหลอดรังสีใหม่ ดังรูป
การค้นพบอิเล็กตรอน
เซอร์โจเซฟ จอห์น ทอมสัน ดัดแปลงหลอดรังสีใหม่ ดังรูป
 รังสีพุ่งจากด้าแคโทดไปยังด้านแอโนด และจะมีรังสีส่วนหนึ่งทะุลุออกไปกระทบกับฉากเรืองแสง ซึ่งฉากที่เรืองแสงมี Zns อยู่ หลังจากนั้นทอมสันได้เพิ่มขั้วไฟฟ้าเข้าไปในหลอดรังสีแคโทดดังรูป
รังสีพุ่งจากด้าแคโทดไปยังด้านแอโนด และจะมีรังสีส่วนหนึ่งทะุลุออกไปกระทบกับฉากเรืองแสง ซึ่งฉากที่เรืองแสงมี Zns อยู่ หลังจากนั้นทอมสันได้เพิ่มขั้วไฟฟ้าเข้าไปในหลอดรังสีแคโทดดังรูป

ปรากฎว่า รังสีนี้จะเบี่ยงเบนเข้าหาขั้วบวก แสดงว่า รังสีนี้ต้องเป็นประจุลบ แต่ไม่ทราบว่าเกิดจากก๊าซในหลอดรังสีแคโทด หรือเกิดจากขั้วไฟฟ้าทอมสันจึงทำการทดลองเกี่ยวกับการนำไฟฟ้าของก๊าซในหลอดรังสีแคโทด พบว่า ไม่ว่าจะใช้ก๊าซใดบรรจุในหลอดหรือใช้โลหะใดเป็นแคโทด จะได้ผลการทดลองเหมือนเดิม จึงสรุปได้ว่า อะตอมทุกชนิดมีอนุภาคที่มีประจุลบเป็นองค์ประกอบ เรียกว่า "อิเล็กตรอน"
การค้นพบโปรตอน
เนื่อง
จากอะตอมเป็นกลางทางไฟฟ้า และการที่พบว่าอะตอมของธาตุทุกชนิดประกอบด้วยอิเล็กตรอนซึ่งมีประจุไฟฟ้าเป็นลบ ทำให้นักวิทยาศาสตร์เชื่อว่าองค์ประกอบอีกส่วนหนึ่งของอะตอม จะต้องมีประจุบวกด้วย ออยแกน โกลด์สไตน์ (Eugen Goldstein) นักวิทยาศาสตร์ชาวเยอรมัน ได้ทดลองเกี่ยวกับหลอดรังสีแคโทด โดยดัดแปลงหลอดรังสีแคโทด ดังรูป


ผลการทดลองของโกสไตน์
เมื่อผ่านกระแสไฟฟ้า ปรากฏว่ามีจุดสว่างเกิดขึ้นทั้งฉากเรืองแสง ก. และฉากเรืองแสง ข.
โกลสไตน์ได้อธิบายว่า จุดเรืองแสงที่เกิดขึ้นบนฉากเรืองแสง ก. จะต้องเกิดจากที่ประกอบด้วยอนุภาคที่มีประจุไฟฟ้าบวก เคลื่อนที่ผ่านรูตรงกลางของแคโทด ไปยังฉากเรืองแสง แต่ยังไม่ทราบว่ารังสีที่มีประจุไฟฟ้าบวกนี้เกิดจากอะตอมของก๊าซ หรือเกิดจากอะตอมของขั้วไฟฟ้า และมีลักษณะเหมือนกันหรือไม่
โกลสไตน์ได้ทดลองเปลี่ยนชนิดของก๊าซในหลอดแก้วปรากฏว่าอนุภาคที่มีประจุไฟฟ้าบวกเหล่านี้มีอัตราส่วนประจุต่อมวลไม่เท่ากัน ขึ้นอยู่กับชนิดของก๊าซที่ใช้และเมื่อทดลองเปลี่ยนโลหะที่ใช้ทำเป็นขั้วไฟฟ้าหลายๆชนิดแต่ให้ก๊าซในหลอดแก้วชนิดเดียวกัน ปรากฏว่า ผลการทดลองได้อัตราส่วนประจุต่อมวลเท่ากันแสดงว่าอนุภาคบวกในหลอดรังสีแคโทดเกิดจากก๊าซ
ไม่ได้เกิดจากขั้วไฟฟ้า
สรุปแบบจำลองของทอมสัน
จากผลการทดลอง ทั้งของทอมสันและโกลด์สไตน
อะตอมมีลักษณะเป็นทรงกลมประกอบด้วยอนุภาคโปรตอนที่มีประจุไฟฟ้าเป็นบวกและอนุภาคอิเล็กตรอนที่มีประจุไฟฟ้าเป็นลบ กระจัดกระจายอย่างสม่ำเสมอในอะตอมอะตอมที่มีสภาพเป็นกลางทางไฟฟ้าจะมีจำนวนประจุบวกเท่ากับจำนวนประจุลบ

2.1.3. แบบจำลองอะตอมของรัทเทอร์ฟอร์ด

ลอร์ดเออร์เนสต์ รัทเทอร์ฟอร์ด ได้ทำการทดลอง โดยการยิงอนุภาคแอลฟาไปยังแผ่นทองคำดังรูป

ผลการทดลอง สรุปได้ดังนี้
• จุด X เป็นจุดที่อนุภาคแอลฟาผ่านไปยังฉากในแนวเส้นตรง แสดงว่า ภายในอะตอมน่าจะมีพื้นที่ว่างเป็นจำนวนมาก เพราะ อนุภาคแอลฟาส่วนใหญ่ทะลุผ่านแผนทองคำเป็นแนวเส้นตรง

• จุด Y อนุภาคแอลฟาเบี่ยงเบนเล็กน้อย แสดงว่าภายในอะตอมควรมีอนุภาคบางอย่างรวมกันเป็นกลุ่มก้อนขนาดเล็ก มีมวลมากพอที่ทำให้อนุภาคแอลฟาวิ่งไปเฉียดแล้วเบี่ยงเบน

• จุด Z อนุภาคแอลฟาสะท้อนกลับ แสดงว่าในอะตอมจะมีอนุภาคบางอย่างที่เป็นกลุ่มก้อน มีทวลมากพอที่ทำให้อนุภาคแอลฟาสะท้อนกลับ

การค้นพบนิวตรอน
สาเหตุที่ค้นพบนิวตรอน
1. เนื่องจากมวลของอะตอมต่าง มักเป็น 2 เท่า หรือมากกว่า 2 เท่าของมวลโปรตรอนรวม
รัทเทอร์ฟอร์ดสันนิษฐานว่า น่าจะมีอนุภาคอีกชนิดหนึ่งอยู่ในนิวเคลียส และอนุภาคนี้ต้องมีมวลใกล้เคียงกันกับมวลของโปรตรอนมาก และต้องเป็นกลางทางไฟฟ้า
2. ทอมสันศึกษาหามวลของอนุภาคบวกของ Ne ปรากฎว่า อนุภาคบวกนี้มีมวล 2 เท่า
ผลการทดลองนี้สนับสนุนว่าจะต้องมีอนุภาคอีกชนิดหนึ่งอยู่ในนิวเคลียส
เชดวิก ได้ยิงอนุภาคแอลฟาไปยัง Be ปรากฎว่าได้อนุภาคชนิดนึ่งออกมา
ซึ่งมีมวลใกล้เคียงกับมวลของโปรตรอนและไม่มีประจุไฟฟ้า เรียกอนุภาคนี้ว่า"นิวตรอน"

สรุปแบบจำลองอะตอมของรัทเทอร์ฟอร์ด
อะตอมประกอบด้วยนิวเคลียสที่มีโปรตอนรวมกันอยู่ตรงกลาง นิวเคลียสมีขนาดเล็ก แต่มีมวลมากและมีประจุเป็นบวก ส่วนอิเล็กตรอนซึ่งมีประจุเป็นลบ และมีมวลน้อยมาก จะวิ่งอยู่รอบนิวเคลียสเป็นบริเวณกว้าง

2.1.4. แบบจำลองอะตอมของโบร์

โบร์ได้ศึกษาแบบจำลองอะตอมขึ้นมาโดยนำแบบจำลองอะตอมของรัทฟอร์ดมาแก้ไข เขาศึกษาสเปกตรัมการเปล่งแสงของธาตุ โดยบรรจุแก๊สไฮโดรเจนในหลอดปล่อยประจุ จากนั้นให้พลังงานเข้าไป
ผลการทดลอง
อิเล็กตรอนเคลื่อนจากขั้วบวกไปขั้วลบชนกับแก๊สไฮโดรเจน จากนั้นเปล่งแสงออกมาผ่านปริซึมทำให้เราเห็นเป็นเส้นสเปกตรัมสีต่าง ๆ ตกบนฉากรับภาพ
สรุปผลการทดลอง
การเปล่งแสงของธาตุไฮโดรเจน เกิดจากอิเล็กตรอนเปลี่ยนระดับพลังงานจากวงโคจรสูงไปสู่วงโคจรต่ำ พร้อมทั้งคายพลังงานในรูปแสงสีต่าง ๆ
สรุปแบบจำลองอะตอมของโบร์
1. อิเล็กตรอนจะอยู่กันเป็นชั้น ๆ แต่ละชั้นเรียกว่า “ระดับพลังงาน”

2. อิเล็กตรอนที่อยู่ในระดับพลังงานวงนอกสุดเรียกว่า เวเลนซ์อิเล็กตรอน (Valent electron)จะเป็นอิเล็กตรอนที่เกิดปฏิกิริยาต่าง ๆ ได้
3. อิเล็กตรอนที่อยู่ในระดับพลังงานวงในอยู่ใกล้นิวเคลียส จะเสถียรมากเพราะประจุบวกจากนิวเคลียสดึงดูดไว้อย่างดี ส่วนอิเล็กตรอนระดับพลังงานวงนอกจะไม่เสถียรเพราะนิวเคลียสส่งแรงไปดึงดูดได้น้อยมาก
4. ระดับการพลังงานวงในจะอยู่ห่างกันมาก ส่วนระดับพลังงานวงนอกจะอยู่ชิดกันมาก
5. การเปลี่ยนระดับพลังงานของอิเล็กตรอน ไม่จำเป็นต้องเปลี่ยนในระดับถัดกัน อาจเปลี่ยนข้ามระดับพลังงานกันก็ได้









เมื่อผ่านกระแสไฟฟ้า ปรากฏว่ามีจุดสว่างเกิดขึ้นทั้งฉากเรืองแสง ก. และฉากเรืองแสง ข.
โกลสไตน์ได้อธิบายว่า จุดเรืองแสงที่เกิดขึ้นบนฉากเรืองแสง ก. จะต้องเกิดจากที่ประกอบด้วยอนุภาคที่มีประจุไฟฟ้าบวก เคลื่อนที่ผ่านรูตรงกลางของแคโทด ไปยังฉากเรืองแสง แต่ยังไม่ทราบว่ารังสีที่มีประจุไฟฟ้าบวกนี้เกิดจากอะตอมของก๊าซ หรือเกิดจากอะตอมของขั้วไฟฟ้า และมีลักษณะเหมือนกันหรือไม่
โกลสไตน์ได้ทดลองเปลี่ยนชนิดของก๊าซในหลอดแก้วปรากฏว่าอนุภาคที่มีประจุไฟฟ้าบวกเหล่านี้มีอัตราส่วนประจุต่อมวลไม่เท่ากัน ขึ้นอยู่กับชนิดของก๊าซที่ใช้และเมื่อทดลองเปลี่ยนโลหะที่ใช้ทำเป็นขั้วไฟฟ้าหลายๆชนิดแต่ให้ก๊าซในหลอดแก้วชนิดเดียวกัน ปรากฏว่า ผลการทดลองได้อัตราส่วนประจุต่อมวลเท่ากันแสดงว่าอนุภาคบวกในหลอดรังสีแคโทดเกิดจากก๊าซ
ไม่ได้เกิดจากขั้วไฟฟ้า
โกลสไตน์ได้อธิบายว่า จุดเรืองแสงที่เกิดขึ้นบนฉากเรืองแสง ก. จะต้องเกิดจากที่ประกอบด้วยอนุภาคที่มีประจุไฟฟ้าบวก เคลื่อนที่ผ่านรูตรงกลางของแคโทด ไปยังฉากเรืองแสง แต่ยังไม่ทราบว่ารังสีที่มีประจุไฟฟ้าบวกนี้เกิดจากอะตอมของก๊าซ หรือเกิดจากอะตอมของขั้วไฟฟ้า และมีลักษณะเหมือนกันหรือไม่
โกลสไตน์ได้ทดลองเปลี่ยนชนิดของก๊าซในหลอดแก้วปรากฏว่าอนุภาคที่มีประจุไฟฟ้าบวกเหล่านี้มีอัตราส่วนประจุต่อมวลไม่เท่ากัน ขึ้นอยู่กับชนิดของก๊าซที่ใช้และเมื่อทดลองเปลี่ยนโลหะที่ใช้ทำเป็นขั้วไฟฟ้าหลายๆชนิดแต่ให้ก๊าซในหลอดแก้วชนิดเดียวกัน ปรากฏว่า ผลการทดลองได้อัตราส่วนประจุต่อมวลเท่ากันแสดงว่าอนุภาคบวกในหลอดรังสีแคโทดเกิดจากก๊าซ
ไม่ได้เกิดจากขั้วไฟฟ้า
สรุปแบบจำลองของทอมสัน
จากผลการทดลอง ทั้งของทอมสันและโกลด์สไตน
อะตอมมีลักษณะเป็นทรงกลมประกอบด้วยอนุภาคโปรตอนที่มีประจุไฟฟ้าเป็นบวกและอนุภาคอิเล็กตรอนที่มีประจุไฟฟ้าเป็นลบ กระจัดกระจายอย่างสม่ำเสมอในอะตอมอะตอมที่มีสภาพเป็นกลางทางไฟฟ้าจะมีจำนวนประจุบวกเท่ากับจำนวนประจุลบ

2.1.3. แบบจำลองอะตอมของรัทเทอร์ฟอร์ด

ลอร์ดเออร์เนสต์ รัทเทอร์ฟอร์ด ได้ทำการทดลอง โดยการยิงอนุภาคแอลฟาไปยังแผ่นทองคำดังรูป

ผลการทดลอง สรุปได้ดังนี้
• จุด X เป็นจุดที่อนุภาคแอลฟาผ่านไปยังฉากในแนวเส้นตรง แสดงว่า ภายในอะตอมน่าจะมีพื้นที่ว่างเป็นจำนวนมาก เพราะ อนุภาคแอลฟาส่วนใหญ่ทะลุผ่านแผนทองคำเป็นแนวเส้นตรง

• จุด Y อนุภาคแอลฟาเบี่ยงเบนเล็กน้อย แสดงว่าภายในอะตอมควรมีอนุภาคบางอย่างรวมกันเป็นกลุ่มก้อนขนาดเล็ก มีมวลมากพอที่ทำให้อนุภาคแอลฟาวิ่งไปเฉียดแล้วเบี่ยงเบน

• จุด Z อนุภาคแอลฟาสะท้อนกลับ แสดงว่าในอะตอมจะมีอนุภาคบางอย่างที่เป็นกลุ่มก้อน มีทวลมากพอที่ทำให้อนุภาคแอลฟาสะท้อนกลับ

การค้นพบนิวตรอน
สาเหตุที่ค้นพบนิวตรอน1. เนื่องจากมวลของอะตอมต่าง มักเป็น 2 เท่า หรือมากกว่า 2 เท่าของมวลโปรตรอนรวม
รัทเทอร์ฟอร์ดสันนิษฐานว่า น่าจะมีอนุภาคอีกชนิดหนึ่งอยู่ในนิวเคลียส และอนุภาคนี้ต้องมีมวลใกล้เคียงกันกับมวลของโปรตรอนมาก และต้องเป็นกลางทางไฟฟ้า
2. ทอมสันศึกษาหามวลของอนุภาคบวกของ Ne ปรากฎว่า อนุภาคบวกนี้มีมวล 2 เท่า
ผลการทดลองนี้สนับสนุนว่าจะต้องมีอนุภาคอีกชนิดหนึ่งอยู่ในนิวเคลียส
เชดวิก ได้ยิงอนุภาคแอลฟาไปยัง Be ปรากฎว่าได้อนุภาคชนิดนึ่งออกมา
ซึ่งมีมวลใกล้เคียงกับมวลของโปรตรอนและไม่มีประจุไฟฟ้า เรียกอนุภาคนี้ว่า"นิวตรอน"

อะตอมประกอบด้วยนิวเคลียสที่มีโปรตอนรวมกันอยู่ตรงกลาง นิวเคลียสมีขนาดเล็ก แต่มีมวลมากและมีประจุเป็นบวก ส่วนอิเล็กตรอนซึ่งมีประจุเป็นลบ และมีมวลน้อยมาก จะวิ่งอยู่รอบนิวเคลียสเป็นบริเวณกว้าง

2.1.4. แบบจำลองอะตอมของโบร์

โบร์ได้ศึกษาแบบจำลองอะตอมขึ้นมาโดยนำแบบจำลองอะตอมของรัทฟอร์ดมาแก้ไข เขาศึกษาสเปกตรัมการเปล่งแสงของธาตุ โดยบรรจุแก๊สไฮโดรเจนในหลอดปล่อยประจุ จากนั้นให้พลังงานเข้าไป
ผลการทดลอง
สรุปผลการทดลอง
การเปล่งแสงของธาตุไฮโดรเจน เกิดจากอิเล็กตรอนเปลี่ยนระดับพลังงานจากวงโคจรสูงไปสู่วงโคจรต่ำ พร้อมทั้งคายพลังงานในรูปแสงสีต่าง ๆ
สรุปแบบจำลองอะตอมของโบร์
1. อิเล็กตรอนจะอยู่กันเป็นชั้น ๆ แต่ละชั้นเรียกว่า “ระดับพลังงาน”

2. อิเล็กตรอนที่อยู่ในระดับพลังงานวงนอกสุดเรียกว่า เวเลนซ์อิเล็กตรอน (Valent electron)จะเป็นอิเล็กตรอนที่เกิดปฏิกิริยาต่าง ๆ ได้
3. อิเล็กตรอนที่อยู่ในระดับพลังงานวงในอยู่ใกล้นิวเคลียส จะเสถียรมากเพราะประจุบวกจากนิวเคลียสดึงดูดไว้อย่างดี ส่วนอิเล็กตรอนระดับพลังงานวงนอกจะไม่เสถียรเพราะนิวเคลียสส่งแรงไปดึงดูดได้น้อยมาก
4. ระดับการพลังงานวงในจะอยู่ห่างกันมาก ส่วนระดับพลังงานวงนอกจะอยู่ชิดกันมาก
5. การเปลี่ยนระดับพลังงานของอิเล็กตรอน ไม่จำเป็นต้องเปลี่ยนในระดับถัดกัน อาจเปลี่ยนข้ามระดับพลังงานกันก็ได้
3. อิเล็กตรอนที่อยู่ในระดับพลังงานวงในอยู่ใกล้นิวเคลียส จะเสถียรมากเพราะประจุบวกจากนิวเคลียสดึงดูดไว้อย่างดี ส่วนอิเล็กตรอนระดับพลังงานวงนอกจะไม่เสถียรเพราะนิวเคลียสส่งแรงไปดึงดูดได้น้อยมาก
4. ระดับการพลังงานวงในจะอยู่ห่างกันมาก ส่วนระดับพลังงานวงนอกจะอยู่ชิดกันมาก
5. การเปลี่ยนระดับพลังงานของอิเล็กตรอน ไม่จำเป็นต้องเปลี่ยนในระดับถัดกัน อาจเปลี่ยนข้ามระดับพลังงานกันก็ได้

สเปกตรัม หมายถึง อนุกรมของแถบสีหรือ หรือเส้นที่ได้จากการผ่านพลังงานรังสีเข้าไปในสเปกโตรสโคป ซึ่งทำให้พลังงานรังสีแยกออกเป็นแถบหรือเป็นเส้นที่มีความยาวคลื่นต่าง ๆ เรียงลำดับกันไป
สเปกโตรสโคป (Spectroscope) หรือสเปกโตรมิเตอร์ (Spectrometer) หมายถึง เครื่องมือที่ใช้แยกสีตามความถี่ หรือเครื่องมือที่ใช้ศึกษาเกี่ยวกับสเปกตรัม สเปกตรัม แบ่งเป็น 2 ประเภท คือ
1. สเปกตรัมแบบต่อเนื่อง (Continuous spectrum)
2. สเปกตรัมไม่ต่อเนื่อง (Discontinuous spectrum)
พลังงานรังสีเกิดจากการเปลี่ยนแปลงของอะตอมจะเรียกว่า “อะตอมมิกสเปกตรัม (Atomic spectrm) ”
ความยาวคลื่น (Wavelength) ( แลมบ์ดา ) หมายถึง ระยะทางที่คลื่นเคลื่อนที่ครบ 1 รอบพอดี มีหน่วยเป็นเมตร ( m )
หรือหน่วยย่อยของเมตร เช่น นาโนเมตร (nm) โดย 1 nm = 10-9 เมตร
ความถี่ของคลื่น n (นิว) หมายถึง จำนวนรอบของคลื่นที่เคลื่อนที่ผ่านจุดใดจุดหนึ่งในเวลา 1 วินาที
มีหน่วยเป็นจำนวนรอบต่อวินาที หรือ เฮิร์ตซ์ ( Hertz) หรือ Hz
คลื่นที่จะศึกษากันในที่นี้เป็นคลื่นแม่เหล็กไฟฟ้าในช่วงความยาวคลื่นระหว่าง 380 ถึง 750 nmซึ่งเป็นช่วงคลื่นที่มีความยาวและความถี่ที่ประสาทตาของคนจะรับได้ ้เรียกคลื่นแม่เหล็กไฟฟ้าช่วงดังกล่าวนี้ว่า “แสงขาว (Visibel light)”
เมื่อให้แสงขาวส่องผ่านปริซึม แสงขาวจะแยกออกเป็นแถบสีต่าง ๆ ต่อเนื่องกัน 7 สี เหมือนสีรุ้ง คือ สีม่วง คราม น้ำเงิน เขียว เหลือง ส้ม และแดง นักวิทยาศาสตร์เรียกแถบสีต่อเนื่องกันทั้ง 7 สีนี้ว่า “ สเปกตรัมของแสงสีขาว ”
ตาราง แถบสีของสเปกตรัมของแสงขาว
เขียนเป็นความสัมพันธ์ได้ดังนี้
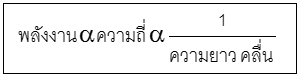
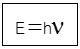 เมื่อ E = พลังงานของ คลื่นแม่เหล็กไฟฟ้า (หน่วยเป็น จูล )
เมื่อ E = พลังงานของ คลื่นแม่เหล็กไฟฟ้า (หน่วยเป็น จูล )
 h = ค่าคงที่ของพลังค์ ( Plank , constant) = 6.625 x 10-34 Js
h = ค่าคงที่ของพลังค์ ( Plank , constant) = 6.625 x 10-34 Js
นิว = ความถี่ของคลื่นแม่เหล็กไฟฟ้า (Hz หรือ s-1)
 c = 2.99 x 108 ms-1 หรือ โดยประมาณ c = 3.0 x 108 ms-1
c = 2.99 x 108 ms-1 หรือ โดยประมาณ c = 3.0 x 108 ms-1
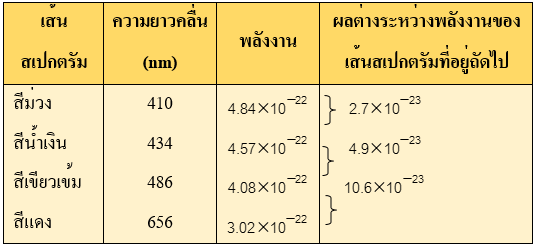
ตาราง ความยาวคลื่นและพลังงานของเส้นสเปกตรัมของไฮโดรเจนที่มองเห็นได้


สเปกโตรสโคป (Spectroscope) หรือสเปกโตรมิเตอร์ (Spectrometer) หมายถึง เครื่องมือที่ใช้แยกสีตามความถี่ หรือเครื่องมือที่ใช้ศึกษาเกี่ยวกับสเปกตรัม สเปกตรัม แบ่งเป็น 2 ประเภท คือ
1. สเปกตรัมแบบต่อเนื่อง (Continuous spectrum)
2. สเปกตรัมไม่ต่อเนื่อง (Discontinuous spectrum)
พลังงานรังสีเกิดจากการเปลี่ยนแปลงของอะตอมจะเรียกว่า “อะตอมมิกสเปกตรัม (Atomic spectrm) ”
หรือหน่วยย่อยของเมตร เช่น นาโนเมตร (nm) โดย 1 nm = 10-9 เมตร
ความถี่ของคลื่น n (นิว) หมายถึง จำนวนรอบของคลื่นที่เคลื่อนที่ผ่านจุดใดจุดหนึ่งในเวลา 1 วินาที
มีหน่วยเป็นจำนวนรอบต่อวินาที หรือ เฮิร์ตซ์ ( Hertz) หรือ Hz
คลื่นที่จะศึกษากันในที่นี้เป็นคลื่นแม่เหล็กไฟฟ้าในช่วงความยาวคลื่นระหว่าง 380 ถึง 750 nmซึ่งเป็นช่วงคลื่นที่มีความยาวและความถี่ที่ประสาทตาของคนจะรับได้ ้เรียกคลื่นแม่เหล็กไฟฟ้าช่วงดังกล่าวนี้ว่า “แสงขาว (Visibel light)”
เมื่อให้แสงขาวส่องผ่านปริซึม แสงขาวจะแยกออกเป็นแถบสีต่าง ๆ ต่อเนื่องกัน 7 สี เหมือนสีรุ้ง คือ สีม่วง คราม น้ำเงิน เขียว เหลือง ส้ม และแดง นักวิทยาศาสตร์เรียกแถบสีต่อเนื่องกันทั้ง 7 สีนี้ว่า “ สเปกตรัมของแสงสีขาว ”
ตาราง แถบสีของสเปกตรัมของแสงขาว
สีของสเปกตรัม
|
ความยาวคลื่น (nm)
|
ม่วง
คราม น้ำเงิน เขียว เหลือง ส้ม แดง |
380 - 420
420 - 460 460 - 490 490 - 580 580 - 590 590 - 650 650 - 700 |
มักซ์ พลังค์ (Max Planck) นักวิทยาศาสตร์ ชาวเยอรมัน ได้พบว่าคลื่นแม่เหล็กไฟฟ้าหรือแสงเป็นพลังงานรูปหนึ่งและพลังงานของคลื่นแม่เหล็กไฟฟ้ามีส่วนสัมพันธ์กับความถี่และความยาวของคลื่น
โดยสรุปเป็นกฎว่า
โดยสรุปเป็นกฎว่า
“ พลังงานของคลื่นแม่เหล็กแม่เหล็กไฟฟ้าจะเป็นสัดส่วนโดยตรงกับความถี่ของคลื่นนั้น ”
เขียนเป็นความสัมพันธ์ได้ดังนี้
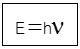 เมื่อ E = พลังงานของ คลื่นแม่เหล็กไฟฟ้า (หน่วยเป็น จูล )
เมื่อ E = พลังงานของ คลื่นแม่เหล็กไฟฟ้า (หน่วยเป็น จูล )นิว = ความถี่ของคลื่นแม่เหล็กไฟฟ้า (Hz หรือ s-1)
เส้นสเปกตรัมของธาตุ
เส้นสเปกตรัมของธาตุ เป็นสมบัติเฉพาะของธาตุหนึ่ง ประกอบด้วยเส้นสเปกตรัมหลายเส้น ธาตุต่างชนิดกันมีเส้นสเปกตรัมต่างกัน แต่อาจมีเส้นสเปกตรัมบางเส้นเหมือนกันได้
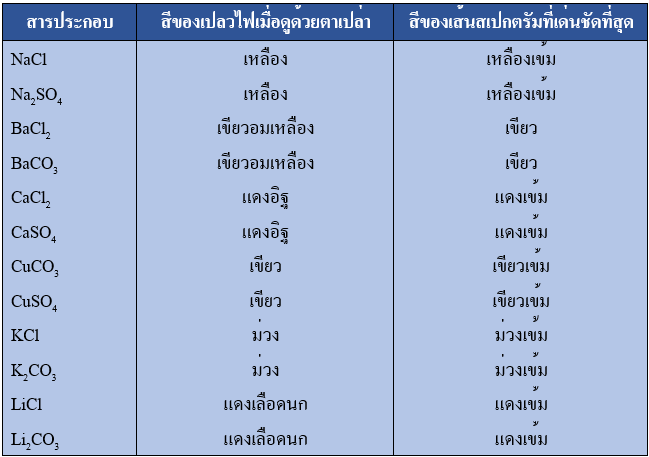
สีเปลวไฟของไอออนของโลหะต่างชนิดกัน ให้สีต่างกัน ได้จากการทำ Flame test โดยการเผาสารประกอบของธาตุด้วยลวดแพลทินัมหรือลวมนิโครม จนเห็นสีเปลวไฟ แล้วส่องสีเปลวไฟด้วยกล้องสเปกโทรสโคป จะเห็นเส้นสเปกตรัมของโลหะได้
ตารางสีของเปลวไฟที่เกิดจากการเผาสารเมื่อดูด้วยตาเปล่า และใช้เส้นสเปกโตรสโคป

การเกิดเส้นสเปกตรัมของธาตุ
การเกิดเส้นสเปกตรัมของธาตุ เกิดจากเมื่ออะตอมได้รับพลังงานเพิ่มขึ้น อิเล็กตรอนมีพลังงานสูงขึ้นจึงสามารถเคลื่อนที่ ไปอยู่ในระดับที่ไกลกว่าเดิม ซึ่งจะไกลเท่าใดขึ้นอยู่กับปริมาณพลังงานที่ได้รับ ภาวะนี้อะตอมจะไม่เสถียร เรียกว่า อยู่ในสถานะกระตุ้น (excited state) ดังนั้นอะตอมจึงมีการปรับตัวเข้าสู่ภาวะที่มีพลังงานต่ำ โดยอิเล็กตรอนจะคายพลังงานส่วนหนึ่งออกมา ซึ่งพลังงาน ส่วนใหญ่จะปรากฏอยู่ในรูปของพลังงานแสงเป็น เส้นสเปกตรัม
การเกิดเส้นสเปกตรัมของธาตุ เกิดจากเมื่ออะตอมได้รับพลังงานเพิ่มขึ้น อิเล็กตรอนมีพลังงานสูงขึ้นจึงสามารถเคลื่อนที่ ไปอยู่ในระดับที่ไกลกว่าเดิม ซึ่งจะไกลเท่าใดขึ้นอยู่กับปริมาณพลังงานที่ได้รับ ภาวะนี้อะตอมจะไม่เสถียร เรียกว่า อยู่ในสถานะกระตุ้น (excited state) ดังนั้นอะตอมจึงมีการปรับตัวเข้าสู่ภาวะที่มีพลังงานต่ำ โดยอิเล็กตรอนจะคายพลังงานส่วนหนึ่งออกมา ซึ่งพลังงาน ส่วนใหญ่จะปรากฏอยู่ในรูปของพลังงานแสงเป็น เส้นสเปกตรัม

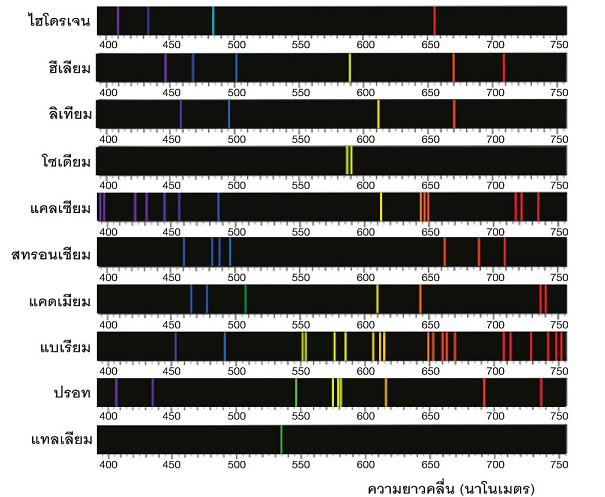
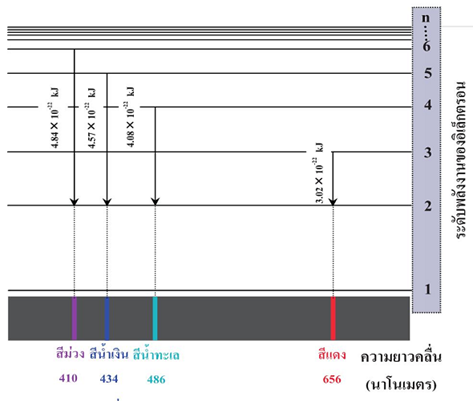
สเปกตรัมของธาตุไฮโดรเจน
นักวิทยาศาสตร์ศึกษาเส้นสเปกตรัมของธาตุไฮโดรเจน ซึ่งเป็นธาตุที่มีอิเล็กตรอนเพียง 1 อิเล็กตรอน พบว่าธาตุไฮโดรเจนมีสเปกตรัมที่ปรากฏในช่วงแสงขาวเมื่อผ่านปริซึม ดังรูป
นักวิทยาศาสตร์ศึกษาเส้นสเปกตรัมของธาตุไฮโดรเจน ซึ่งเป็นธาตุที่มีอิเล็กตรอนเพียง 1 อิเล็กตรอน พบว่าธาตุไฮโดรเจนมีสเปกตรัมที่ปรากฏในช่วงแสงขาวเมื่อผ่านปริซึม ดังรูป


จากตารางพบว่า ผลต่างระหว่างพลังงานของเส้นสเปกตรัมสีม่วงกับเส้นสีน้ำเงิน ต่างกันน้อยที่สุด ส่วนเส้นสเปกตรัมสีน้ำทะเล กับเส้นสีแดงมีพลังงานต่างกันมากที่สุด แสดงว่าความแตกต่างระหว่างพลังงานของระดับพลังงานแต่ละระดับที่อยู่ถัดกันไป จะไม่เท่ากันตลอด และความแตกต่างจะมีค่าน้อยลงตามลำดับ เมื่อระดับพลังงานสูงขึ้นจะยิ่งอยู่ชิดกันขึ้น และการเปลี่ยนระดับพลังงานของอิเล็กตรอน ไม่จำเป็นต้องเปลี่ยนไปยังระดับพลังงานที่อยู่ติดกัน อาจจะมีการเปลี่ยนข้ามระดับได้ แต่เมื่ออิเล็กตรอนรับพลังงานแล้วจะขึ้นไปอยู่ระหว่าง ระดับพลังงานไม่ได้ จะต้องขึ้นไปอยู่ในระดับใดระดับหนึ่งเสมอ
2.1.5.แบบจำลองอะตอมแบบกลุ่มหมอก
จากแบบจำลองอะตอมของโบร์ ไม่สามารถอธิบายสมบัติบางอย่างของธาตุที่มีหลายอิเล็กตรอนได้จึงมีการศึกษาเพิ่มเติมและเชื่อว่า อิเล็กตรอนมีสมบัติเป็นได้ทั้ง คลื่นและอนุภาคการศึกษาเพิ่มเติมและเชื่อว่า อิเล็กตรอนมีสมบัติเป็นได้ทั้ง คลื่นและอนุภาค
สรุปแบบจำลองอะตอมแบบกลุ่มหมอกแบบจำลองนี้เชื่อว่า
1. อิเล็กตรอนไม่ได้เคลื่อนที่เป็นวงกลม แต่เคลื่อนที่ไปรอบๆนิวเคลียส
เป็นรูปทรงต่างๆตามระดับพลังงาน
2. ไม่สามารถบอกตำแหน่งที่แน่นอนของอิเล็กตรอนไ้ด้ เนื่องจากอิเล็กตรอนมีขนาดเล็กมาก
และเคลื่อนที่รวดเร็วตลอดเวลาไปทั่วทั้งอะตอม
3. อะตอมประกอบด้วยกลุ่มหมอกของอิเล็กตรอนรอบนิวเคลียส บริเวณที่มีหมอกทึบ
แสดงว่ามีโอกาสพบอิเล็กตรอนได้มากกว่าบริเวณที่มีหมอกจาง ดังรูปที่แสดงไว้
1. อิเล็กตรอนไม่ได้เคลื่อนที่เป็นวงกลม แต่เคลื่อนที่ไปรอบๆนิวเคลียส
เป็นรูปทรงต่างๆตามระดับพลังงาน
2. ไม่สามารถบอกตำแหน่งที่แน่นอนของอิเล็กตรอนไ้ด้ เนื่องจากอิเล็กตรอนมีขนาดเล็กมาก
และเคลื่อนที่รวดเร็วตลอดเวลาไปทั่วทั้งอะตอม
3. อะตอมประกอบด้วยกลุ่มหมอกของอิเล็กตรอนรอบนิวเคลียส บริเวณที่มีหมอกทึบ
แสดงว่ามีโอกาสพบอิเล็กตรอนได้มากกว่าบริเวณที่มีหมอกจาง ดังรูปที่แสดงไว้



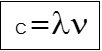
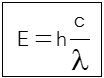
ไม่มีความคิดเห็น:
แสดงความคิดเห็น