พันธะโคเวเลนต์ คือ พันธะเคมีที่เกิดขึ้นระหว่างอะตอมของธาตุอโลหะกับธาตุโลหะที่เข้ามาสร้างแรงยึดเหนี่ยวต่อกัน เนื่องจากธาตุอโลหะจะมีสมบัติเป็นตัวรับอิเล็กตรอนที่ดีและยากต่อการสูญเสียอิเล็กตรอน ดังนั้นอิเล็กตรอนของธาตุทั้งสองจึงต่างส่งแรงดึงดูดเพื่อที่จะดึงดูดอิเล็กตรอนของอีกฝ่ายให้เข้าหาตนเอง ทำให้แรงดึงดูดจากนิวเคลียสของอะตอมทั้งสองหักล้างกัน ดังนั้นอิเล็กตรอนจึงไม่มีการหลุดไปอยู่ในอะตอมใดอะตอมหนึ่งโดยเฉพาะ แต่จะมีลักษณะเหมือนเป็นอิเล็กตรอนที่อยู่กึ่งกลางระหว่างอะตอมทั้งสอง เรียกอิเล็กตรอนที่อยู่กึ่งกลางอะตอมทั้งสอง เรียกอิเล็กตรอนที่ถูกอะตอมใช้ร่วมกันในการสร้างพันธะเคมีว่า อิเล็กตรอนคู่ร่วมพันธะ(Bonding pair electron)
พันธะโคเวเลนต์ของอะตอมเกิดขึ้นจากการใช้อิเล็กตรอนร่วมกันของอะตอม โดยอาจเกิดจากการใช้อิเล็กตรอนร่วมกันเพียงคู่เดียว สองคู่ หรือสามคู่ก็ได้ขึ้นอยู่กับอะตอมคู่ที่เข้ามร่วมสร้างพันธะกันว่ายังขาดเวเลนซ์อิเล็กตรอนอยู่อีกเท่าใดจึงจะครบ 8 ตามกฎออกเตต ดังนั้นพันธะโคเวเลนต์จึงสามารถแบ่งออกได้เป็น 3 ชนิด ตามจำนวนอิเล็กตรอนที่มีการใช้ร่วมกัน ดังนี้
1.พันธะเดี่ยว (single bond) คือ พันธะโคเวเลนต์ที่เกิดจากอะตอมคู่ที่เข้ามาร่วมสร้างพันธะต่อกันมีการใช้ร่วมสร้างพันธะต่อกันมีการใช้อิเล็กตรอนร่วมกัน 1 คู่
2.พันธะคู่ (double bond) คือ พันธะโคเวเลนต์ที่เกิดจากอะตอมคู่ที่เข้ามาร่วมสร้างพันธะต่อกันมีการใช้อิเล็กตรอนร่วมกัน 2 คู่

3.3.2 สูตรโมเลกุลและชื่อของสารโคเวเลนต์
การเรียกชื่อสารประกอบโคเวเลนต์ (Names of Covalent Compounds)
1. อ่านชื่อธาตุที่อยู่ด้านหน้าก่อนตามด้วยธาตุที่อยู่ด้านหลัง โดยเปลี่ยนเสียงพยางค์ท้ายเป็น ไ-ด์ (ide )
2. อ่านระบุจำนวนอะตอมของธาตุด้วยเลขจำนวนในภาษากรีก ได้แก่
1 = mono- 2 = di- 3 = tri-
4 = tetra- 5 = penta- 6 = hexa
7 = octa- 8 = nona- 9 = deca
3. ถ้าธาตุแรกมีอะตอมเดียว ไม่ต้องอ่านระบุจำนวนอะตอมของธาตุนั้น แต่ถ้าธาตุหลังมีเพียงหนึ่งอะตอมก็ต้องระบุจำนวนอะตอมด้วยเสมอ
ตัวอย่างการอ่านชื่อ
CO2 อ่านว่า คาร์บอนไดออกไซด์
CO อ่านว่า คาร์บอนมอนออกไซด์
BF3 อ่านว่า โบรอนไตรฟลูออไรด์
N2O อ่านว่า ไดไนโตรเจนมอนอกไซด์
N2O5 อ่านว่า ไดไนโตรเจนเพนตอกไซด์
P4O10 อ่านว่า เตตระฟอสฟอรัสเดคะออกไซด์
OF2 อ่านว่า ออกซิเจนไดฟลูออไรด์
CCl4 อ่านว่า คาร์บอนเตตระคลอไรด์
3.3.3 ความยาวพันธะและพลังงานพันธะของสารโคเวเลนต์
พลังงานพันธะ หมายถึง พลังงานที่น้อยที่สุดที่ใช้เพื่อสลายพันธะ
ที่ยึดเหนี่ยวระหว่างอะตอมคู่หนึ่งๆในโมเลกุลในสถานะแก๊ส พลังงาน
พันธะสามารถบอกถึงความแข็งแรงของพันธะเคมีได้ โดยพันธะที่
แข็งแรงมากจะมีพลังงานพันธะมาก และพันธะที่แข็งแรงน้อยจะมี
พลังงานพันธะน้อย
พลังงานพันธะเฉลี่ย หมายถึง ค่าพลังงานเฉลี่ยของพลังงาน
สลายพันธะ ของอะตอมคู่หนึ่งๆ ซึ่งเฉลี่ยจากสารหลายชนิด เช่น การ
สลายโมเลกุลมีเทน (CH4) ให้กลายเป็นอะตอมคาร์บอนและ
ไฮโดรเจน มีสมการและค่าพลังงานที่เกี่ยวข้องดังนี้
CH4(g) + 435 kJ → CH3(g) + H(g)
CH3(g) + 453 kJ → CH2(g) + H(g)
CH2(g) + 425 kJ → CH(g) + H(g)
CH(g) + 339 kJ → C(g) + H(g)
เราจะเห็นได้ว่าการสลายพันธะระหว่าง C-H ในแต่ละพันธะของ
โมเลกุลมีเทน (CH4) จะใช้พลังงานไม่เท่ากัน ดังนั้น เมื่อนำค่า
พลังงานทุกค่ามาเฉลี่ย ก็จะได้เป็นค่าพลังงานพันธะเฉลี่ยนั่นเอง ดัง
แสดงในตาราง

ความยาวพันธะ หมายถึง ระยะระหว่างจุดศูนย์กลางของนิวเคลียสของอะตอมทั้งสองที่เกิดพันธะกัน (หน่วยเป็น Angstrom , 10-10 m , A0 )

จากหัวข้อการเกิดพันธะโคเวเลนต์ นักเรียนทราบแล้วว่าอะตอม
ไฮโดรเจน 2 อะตอมเข้าใกล้กันเป็นระยะทาง 0.74 อังสตรอม (หรือ
74 พิโคเมตร) ซึ่งเป็นระยะทางที่เหมาะสมในการเกิดพันธะโคเวเลนต์
ระหว่างไฮโดรเจน โดยระยะนี้เรียกว่า "ความยาวพันธะ" โดยปกติ
แล้วเราสามารถหาความยาวพันธะของสารได้จากการศึกษาการเลี้ยว
เบนของรังสีเอ็กซ์ (X-ray diffraction ; XRD) ผ่านผลึกของสาร
ทั้งนี้ความยาวพันธะระหว่างอะตอมคู่เดียวกันในโมเลกุลของสารต่าง
ชนิดกัน จะมีค่าไม่เท่ากัน เช่น
สาร
|
สูตรโมเลกุล
|
ความยาวพันธะ O-H (pm)
|
น้ำ
|
H2O
|
95.8
|
เมทานอล
|
CH3OH
|
95.6
|
ดังนั้น ความยาวพันธะระหว่างอะตอมคู่หนึ่ง จึงหาได้จากค่าเฉลี่ย
ของความยาวพันธะระหว่างอะตอมคูjเดียวกันในโมเลกุลต่างๆ เมื่อ
กล่าวถึงความยาวพันธะ โดยทั่วไปจึงหมายถึง “ความยาวพันธะ
เฉลี่ย”

ความสัมพันธ์ระหว่างความยาวพันธะกับพลังงานพันธะ
ความยาวพันธะและพลังงานพันธะ จะสามารถเปรียบเทียบ
กันได้ก็ต่อเมื่อเป็นพันธะที่เกิดจากอะตอมของธาตุคู่เดียวกัน
ถ้าเป็นอะตอมต่างคู่กันเทียบกันไม่ได้ เช่น

ดังนั้น ถ้าความยาวพันธะยิ่งสั้น พลังงานพันธะก็จะยิ่งมาก หรือ
พันธะมีความเสถียรมาก ซึ่งจากรูปเราสามารถสรุปได้ ดังนี้
1. ความยาวพันธะ พันธะเดี่ยว > พันธะคู่ > พันธะสาม
2. พลังงานพันธะ พันธะสาม > พันธะคู่ > พันธะเดี่ยว


ความแข็งแรง : พันธะสาม > พันธะคู่ > พันธะเดี่ยว
3.3.4 รูปร่างโมเลกุล
สูตร AXE ของโมเลกุล
|
รูปทรงเรขาคณิตของกลุ่มอิเล็กตรอน
รอบอะตอมกลาง |
ภาพแสดงรูปทรงเรขาคณิต
ของโมเลกุล | สารตัวอย่าง | มุมระหว่างพันธะ | |
โมเลกุลอะตอมคู่
(ไม่มีสัญลักษณ์AXE) | - | เส้นตรง (linear) | HF, O2, H2,N2,Cl2 | - | |
AX2E0 | BeCl2, HgCl2, CO2 | 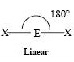 | |||
AX3E0 | BF3, CO32−, NO3−, SO3 | 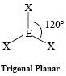 | |||
AX2E1 | NO2−, SO2, O3 | 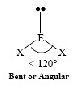 | |||
AX4E0
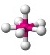
| ทรงสี่หน้า | CH4, PO43−, SO42−, ClO4−CO32- | 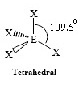 | ||
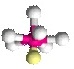
AX3E1
| ทรงสี่หน้า | NH3, PCl3 | 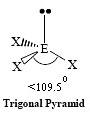 | ||
AX2E2 |
 ทรงสี่หน้า | H2O, OF2 | 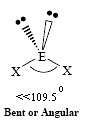 | ||
AX5E0 |
 พีระมิดคู่ฐานสามเหลี่ยม | PCl5 | ในแนวระนาบฐานพีระมิดทำมุมกัน 120 องศา ส่วนส่วนสูงของพีระมิดทำมุม 90 องศากับระนาบ 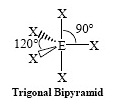 | ||
AX4E1 |
พีระมิดคู่ฐานสามเหลี่ยม |
| SF4 | 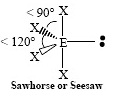 | |
AX3E2
|
พีระมิดคู่ฐานสามเหลี่ยม |
| ClF3, BrF3 | น้อยกว่า 90 องศา  | |
AX2E3
|
พีระมิดคู่ ฐานสามเหลี่ยม | XeF2, I3− | 180 องศา 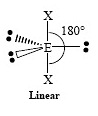 | ||
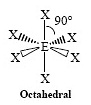
AX6E0
|
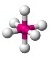 ทรงแปดหน้า |
SF6
|
90 องศา
 | ||
AX5E1
|
ทรงแปดหน้า | ClF5, BrF5 | 90 องศา 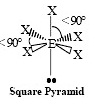 | ||
AX4E2
|
ทรงแปดหน้า |
สี่เหลี่ยมจัตุรัส (square plana) | XeF4 | 90 องศา | |
AX7E0
|
 พีระมิดคู่ฐานห้าเหลี่ยม (pentagonal bipyramid) |
 พีระมิดคู่ฐานห้าเหลี่ยม (pentagonal bipyramid) | IF7 | ในแนวระนาบฐานพีระมิดทำมุมกัน 72 องศา ส่วนส่วนสูงของพีระมิดทำมุม 90 องศากับระนาบ | |
AX6E1
| 
พีระมิดคู่ฐานห้าเหลี่ยม
| 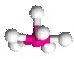
พีระมิดฐานห้าเหลี่ยม
(pentagonal pyramid) | XeF6 | ในแนวระนาบฐานพีระมิดทำมุมกัน 72 องศา ส่วนส่วนสูงของพีระมิดทำมุมน้อยกว่า 90 องศากับระนาบ |
3.3.5 สภาพขั้วโมเลกุลโคเวเลนต์
ธาตุที่มีจำนวนประจุในนิวเคลียสมาก แต่มีระยะระหว่างเวเลนต์อิเล็กตรอนกับนิวเคลียสห่างกันน้อยจะมีค่าอิเล็กโทรเนกาติวิตีสูงกว่าธาตุที่มีระยะระหว่างเวเลนต์อิเล็กตรอนกับนิวเคลียสห่างกันมาก
อะตอมที่มีค่าอิเล็กโทรเนกาติวิตีสูง มีแนวโน้มที่จะแสดงอำนาจไฟฟ้าลบ
อะตอมที่มีค่าอิเล็กโทรเนกาติวิตีต่ำ มีแนวโน้มที่จะแสดงอำนาจไฟฟ้าบวก
ลักษณะสำคัญของพันธะโคเวเลนต์ไม่มีขั้ว
1. เป็นพันธะโคเวเลนต์ที่เกิดกับคู่อะตอมของธาตุชนิดเดียวกัน
2. เป็นพันธะโคเวเลนต์ที่มีการกระจายอิเล็กตรอนให้แต่ละอะตอมเท่ากัน
3. พันธะโคเวเลนต์ไม่มีขั้วอาจจะเกิดกับพันธะโคเวเลนต์ชนิดพันธะเดี่ยว เช่น Cl - Cl พันธะโคเวเลนต์ชนิดพันธะคู่ เช่น O = O และพันธะโคเวเลนต์ชนิดพันธะสาม เช่น N N
4. พันธะโคเวเลนต์ที่ไม่มีขั้วเกิดในโมเลกุลใดเรียกว่า โมเลกุลไม่มีขั้ว (non- polar molecule)
ลักษณะสำคัญของพันธะโคเวเลนต์มีขั้ว
1. พันธะโคเวเลนต์มีขั้วเกิดกับคู่อะตอมของธาตุต่างชนิดกันที่มีค่าอิเล็กโทรเนกาติวิตีต่างกัน
2. เป็นพันธะโคเวเลนต์ที่มีการกระจายอิเล็กตรอนในแต่ละอะตอมไม่เท่ากัน
3. พันธะโคเวเลนต์มีขั้วเกิดในโมเลกุลใด โมเลกุลนั้นจะมีขั้วหรืออาจจะไม่มีขั้วก็ได้ แต่ถ้าพันธะโคเวเลนต์มีขั้ว เกิดในโมเลกุลที่มีเพียง 2 อะตอม โมเลกุลนั้นต้องเป็นโมเลกุลมีขั้วเสมอ
เขียนสัญลักษณ์แสดงขั้วของพันธะ
ใช้เครื่องหมาย อ่านว่า เดลตา โดยกำหนดให้ว่า พันธะมีขั้วใดที่อะตอมแสดงอำนาจไฟฟ้าลบ (เป็นอะตอมที่มีค่าอิเล็กโทรเนกาติวิตีสูง) ใช้เครื่องหมายแทนด้วย และพันธะโคเวเลนต์มีขั้วใดที่อะตอมแสดงอำนาจไฟฟ้าบวก (เป็นอะตอมที่มีค่าอิเล็กโทรเนกาติวิตีต่ำ )ใช้เครื่องหมายแทนด้วย เช่น HF และ ClF

ขั้วของโมเลกุล
จากความรู้เรื่องพันธะโเวเลนต์มีขั้ว และพันธะโคเวเลนต์ไม่มีขั้วสามารถนำมาแบ่งประเภทของโมเลกุลโคเวเลนต์ได้เป็นโมเลกุลมีขั้ว และโมเลกุลไม่มีขั้ว แต่โมเลกุลโคเวเลนต์ใดจะเป็นโมเลกุลมีขั้ว หรือ ไม่มีขั้วนั้นสามารถพิจารณาได้ดังนี้
ก. โมเลกุลที่มีเพียง 2 อะตอม
ถ้าโมเลกุลโคเวเลนต์ใดมีเพียง 2 อะตอม และเป็นอะตอมของธาตุชนิดเดียวกัน พันธะที่เกิดขึ้นในโมเลกุลเป็นพันธะโคเวเลนต์ไม่มีขั้ว ดังนั้น โมเลกุลก็จะเป็นโมเลกุลไม่มีขั้วด้วย เช่น H2, O2, N2
ถ้าโมเลกุลโคเวเลนต์ใดมีเพียง 2 อะตอม และเป็นอะตอมของธาตุต่างชนิดกัน พันธะที่เกิดขึ้นในโมเลกุลเป็นพันธะโคเวเลนต์มีขั้ว ดังนั้นโมเลกุลก็จะเป็นโมเลกุลมีขั้วด้วย เช่น HCl , ClF , HI
ข. โมเลกุลที่มี 3 อะตอมหรือมากกว่า
ถ้าโมเลกุลที่เกิดจากพันธะมีขั้ว และมีรูปร่างของโมเลกุลสมมาตร โมเลกุลนั้นจะเป็นโมเลกุลไม่มีขั้ว เพราะมีผลรวมของทิศทางของแรงดึงดูดอิเล็กตรอนทั้งหมดในโมเลกุลเป็นศูนย์ เช่น
3.3.6 แรงยึดเหนี่ยวระหว่างโมเลกุลและสมบัติของสารโคเวเลนต์
การเปลี่ยนสถานะของสารต้องมีการให้ความร้อนแก่สาร
เพื่อให้อนุภาคของสารมีพลังงานจลน์สูงพอที่จะหลุดออกจากกัน
แสดงว่าสารแต่ละสถานะมีแรงยึดเหนี่ยวระหว่างโมเลกุล
ซึ่งเรียงลำดับจากมากไปน้อยดังนี้ ของแข็ง > ของเหลว > ก๊าซ
การเปลี่ยนสถานะของสารโคเวเลนต์ มีการทำลายแรงยึดเหนี่ยวระหว่างโมเลกุลเท่านั้น ไม่มีการทำลายพันธะเคมี ดังนั้นสารที่มีจุดเดือดจุดหลอมเหลวสูง แสดงว่าแรงยึดเหนี่ยวระหว่างโมเลกุลสูง
ประเภทของแรงยึดเหนี่ยวระหว่างโมเลกุลโคเวเลนต์ มีดังนี้
การเปลี่ยนสถานะของสารโคเวเลนต์ มีการทำลายแรงยึดเหนี่ยวระหว่างโมเลกุลเท่านั้น ไม่มีการทำลายพันธะเคมี ดังนั้นสารที่มีจุดเดือดจุดหลอมเหลวสูง แสดงว่าแรงยึดเหนี่ยวระหว่างโมเลกุลสูง
ประเภทของแรงยึดเหนี่ยวระหว่างโมเลกุลโคเวเลนต์ มีดังนี้
สมบัติของสารประกอบโคเวเลนต์
1. มีจุดเดือดจุดและหลอมเหลวต่ำ เพราะจะทำให้เดือดหรือหลอมเหลวต้องใช้พฃังงานไปในการทำลายแรงยึดเหนี่ยวระหว่างโมเลกุล ( ไม่ได้ ทำลายพันธะโคเวเลนต์ ยกเว้นโครงผลึกร่างตาข่าย ) อาจจะแบ่งสารโคเวนต์ตามจุดเดือด จุดหลอมเหลว จะได้ 4 พวกดังนี้
1.1 สารโคเวเลนต์ไม่มีขั้ว พวกนี้จะมีจุดเดือดจุดหลอมเหลวต่ำกว่าพวกอื่นๆ เพราะโมเลกุลยึดเหนี่ยวกันด้วยแรงลอนดอนอย่างเดียวเท่านั้น
1.2 สารโคเวเลนต์มีขั้ว พวกนี้จะมีจุดเดือดจุดหลอมเหลวสูงกว่าพวกไม่มีขั้ว เพราะยึดเหนี่ยวโมเลกุลด้วยแรง 2 แรง คือแรงลอนดอลและ แรงดึงดูดระหว่างขั้ว
1.3 สารโคเวเลนต์ที่สามารถสร้างพันธะไฮโดรเจนได้ เช่น HF , NH3 , H2O พวกนี้จะมีจุดเดือดจุดหลอมเหลวสูงกว่าสารโคเวเลนต์ที่มีขั้ว เพราะโมเลกุลยึดเหนี่ยวกันด้วยแรงแวนเดอร์วาลส์และพันธะไฮโดรเจน
1.4 พวกที่มีโครงสร้างเป็นโครงผลึกร่างตาข่าย เช่น เพชร แกรไฟต์ คาร์บอรันดัม ซิลิกอนไดออกไซด์ พวกนี้มีจุดเดือดจุดหลอมเหลวสูงมาก ซึ่งโดยทั่วไปสารโคเวเลนต์มีจุดเดือดจุดหลอมเหลวต่ำ ที่เป็นเช่นนี้เพราะการจัดเรียงอะตอมภายในผลึก
2. สารโคเวเลนต์จะไม่นำไฟฟ้าไม่ว่าจะอยู่ในสถานะใด ( ยกเว้น แกรไฟต์ ) เนื่องจากไม่มีอิเล็กตรอนอิสระ และเมื่อหลอมเหลวไม่แตกตัว เป็นไอออน
3.โมเลกุลที่มีขั้วสามารถละลายในตัวทำละลายที่โมเลกุลมีขั้วได้ และโมเลกุลที่ไม่มีขั้วสามารถละลายในตัวทำละลายที่ไม่มีขั้วได้ (มีขั้วกับมีขั้ว , ไม่มีขั้วกับไม่มีขั้ว= ละลายกันได้ แต่มีขั้วกับไม่มีขั้วไม่ละลายกัน )
1.1 สารโคเวเลนต์ไม่มีขั้ว พวกนี้จะมีจุดเดือดจุดหลอมเหลวต่ำกว่าพวกอื่นๆ เพราะโมเลกุลยึดเหนี่ยวกันด้วยแรงลอนดอนอย่างเดียวเท่านั้น
1.2 สารโคเวเลนต์มีขั้ว พวกนี้จะมีจุดเดือดจุดหลอมเหลวสูงกว่าพวกไม่มีขั้ว เพราะยึดเหนี่ยวโมเลกุลด้วยแรง 2 แรง คือแรงลอนดอลและ แรงดึงดูดระหว่างขั้ว
1.3 สารโคเวเลนต์ที่สามารถสร้างพันธะไฮโดรเจนได้ เช่น HF , NH3 , H2O พวกนี้จะมีจุดเดือดจุดหลอมเหลวสูงกว่าสารโคเวเลนต์ที่มีขั้ว เพราะโมเลกุลยึดเหนี่ยวกันด้วยแรงแวนเดอร์วาลส์และพันธะไฮโดรเจน
1.4 พวกที่มีโครงสร้างเป็นโครงผลึกร่างตาข่าย เช่น เพชร แกรไฟต์ คาร์บอรันดัม ซิลิกอนไดออกไซด์ พวกนี้มีจุดเดือดจุดหลอมเหลวสูงมาก ซึ่งโดยทั่วไปสารโคเวเลนต์มีจุดเดือดจุดหลอมเหลวต่ำ ที่เป็นเช่นนี้เพราะการจัดเรียงอะตอมภายในผลึก
2. สารโคเวเลนต์จะไม่นำไฟฟ้าไม่ว่าจะอยู่ในสถานะใด ( ยกเว้น แกรไฟต์ ) เนื่องจากไม่มีอิเล็กตรอนอิสระ และเมื่อหลอมเหลวไม่แตกตัว เป็นไอออน
3.โมเลกุลที่มีขั้วสามารถละลายในตัวทำละลายที่โมเลกุลมีขั้วได้ และโมเลกุลที่ไม่มีขั้วสามารถละลายในตัวทำละลายที่ไม่มีขั้วได้ (มีขั้วกับมีขั้ว , ไม่มีขั้วกับไม่มีขั้ว= ละลายกันได้ แต่มีขั้วกับไม่มีขั้วไม่ละลายกัน )
3.3.7 สารโคเวเลนต์ร่างตาข่าย
สารโคเวเลนต์ที่ศึกษามาแล้วมีโครงสร้างโมเลกุลขนาดเล็ก มีจุดหลอมเหลวและจุดเดือดต่ำ แต่มีสารโคเวเลนต์บางชนิดมีจุดเดือดจุดหลอมเหลวจะสูงมาก โครงสร้างโมเลกุลขนาดใหญ่เพราะเกาะกันแบบโครงร่างตาข่าย เรียกว่า สารโครงผลึกร่างตาข่าย เช่น เพชร แกรไฟต์ SiC, SiO2
12.1 เพชร (Diamond)
เพชร เป็นอัญรูปหนึ่งของคาร์บอนและเป็นผลึกร่างตาข่าย โครงสร้างของเพชร ประกอบด้วยอะตอมของคาร์บอน ซึ่งคาร์บอนแต่ละอะตอมใช้เวเลนซ์อิเล็กตรอนทั้งหมดสร้างพันธะแบบโคเวเลนต์กับอะตอมคาร์บอน ไม่นำไฟฟ้า เพราะว่าคาร์บอนสร้างพันธะไปทุกทิศทุกทาง ทำให้เพชรมีความแข็งมากกว่าอัญรูปอื่น ๆ ของคาร์บอน

12.2 แกรไฟต์ (Graphite)
แกรไฟต์ เป็นผลึกโคเวเลนต์และเป็นอีกรูปหนึ่งของคาร์บอนแต่มีโครงสร้างต่างจากเพชรคือ อะตอมคาร์บอนจะสร้างพันธะ โคเวเลนต์ต่อกันเป็นวง วงละ 6 อะตอมต่อเนื่องกันอยู่ภายในระนาบเดียวกัน ซึ่งการจัดเรียงตัวแบบโครงผลึกร่างตาข่ายนี้ทำให้แกรไฟต์มีจุดเดือดจุดหลอมเหลวสูง และสามารถนำไฟฟ้าได้ เนื่องจากคาร์บอนในโครงผลึกของ แกรไฟต์มี 4 เวเลนซ์อิเล็กตรอน แต่ละอะตอมสร้างพันธะกับคาร์บอนข้างเคียง 3 อะตอม จึงเหลืออีก 1อิเล็กตรอนอิสระที่สามารถเคลื่อนที่ได้ภายในชั้น และแต่ละชั้นไม่ได้สร้างพันธะกัน จึงทำให้ระหว่างชั้นไม่มีความแข็งแรงมาก สามารถเลื่อนไถลได้ง่าย ทำให้มีสมบัติในการหล่อลื่น เราจึงนำไปทำไส้ดินสอ สารหล่อลื่น เป็นต้น

12.3 ซิลิคอนไดออกไซด์ (SO2) หรือซิลิกา
ซิลิคอนไดออกไซด์เป็นผลึกโคเวเลนต์ที่มีโครงสร้างเป็นผลึกร่างตาข่าย อะตอมของซิลิคอนจัดเรียงตัวเหมือนคาร์บอนในผลึกเพชร แต่มีออกซิเจนคั่นอยู่ระหว่างอะตอมของซิลิคอนแต่ละคู่ ผลึกซิลิคอนไดออกไซด์จึงมีจุดหลอมเหลวสูง และมีความแข็งสูง ใช้เป็นวัสดุในการทำแก้ว ทำส่วนประกอบของนาฬิกาควอร์ตซ์ ใยแก้วนำแสง
(5).jpg)
สารประกอบอื่นๆ ของซิลิคอนที่มีโครงสร้างเป็นโครงผลึกร่างตาข่าย ได้แก่ ซิลิคอนคาร์ไบด์ ( SiC ) หรือ คาร์โบรันดัม มีจุดหลอมเหลวสูง มีความแข็งมาก ใช้ทำเครื่องบด เครื่องโม่ หินลับมีด








ไม่มีความคิดเห็น:
แสดงความคิดเห็น